Dans un contexte de santé publique en constante évolution, les nouvelles recommandations concernant l’administration de la vitamine D suscitent un intérêt croissant. Essentielle pour le maintien d’une bonne santé osseuse et le soutien du système immunitaire, la vitamine D joue un rôle crucial dans le bien-être général. Cet article explore les dernières directives du ministère de la santé sur la supplémentation en vitamine D, en mettant en lumière les dosages recommandés.
Une étude réalisée dans la région de Blida menée sur 125 enfants âgés de 01 à 23 mois révèle le modèle de supplémentation en vitamine D, qui consiste en une première dose de 200 000 UI à 1 mois et une deuxième dose de 200 000 UI à 6 mois, semble efficace pour améliorer le statut en vitamine D3 (1).
Cette étude a montré qu’aucun enfant ayant reçu cette supplémentation en vit D ne présente de carence sévère, néanmoins la prévalence de la carence en vitamine D reste élevée chez les enfants non supplémentés.Toutefois cette étude n’a pas démontré l’innocuité de la méga dose utilisée. (1).
Plusieurs études mettent en garde contre l’utilisation de méga doses de vitamine D, en particulier chez les nourrissons et les jeunes enfants en raison de l’intoxication à la vitamine D qui peut entraîner plusieurs complications, dont une hypercalcémie aiguë, qui se manifeste par des symptômes tels que la polyurie, l’hypertension artérielle et l’insuffisance rénale aiguë. De plus, une intoxication chroniquepeut entraîner une hypercalciurie permanente (2).
L’Agence nationale française de sécurité du médicament et des produits de santé (ANSM) a également signalé des cas d’hypercalcémie sévère chez des nouveau-nées supplémentés en vitamine D, ayant reçu des compléments alimentaires enrichis en vitamine D (3).
Pour cela les experts recommandent d’éviter les méga doses de vitamine D supérieures à 200 000 UI en une seule prise, et de favoriser une supplémentation quotidienne 400 à 800 UI qui est généralement suffisante pour prévenir les carences et la toxicité et maintenir un statut idéal en vitamine D (4).
L’adoption de cette méthode de supplémentation quotidienne peut être contraignante, car elle exige un engagement constant qui peut perturber les routines habituelles. Pour y remédier, l’Algérie a mis en place un nouveau schéma de supplémentation, consistant en l’administration de 100 000 UI à 1 mois, 6 mois, 12mois et 18 mois. De plus, une ampoule de 100 000 UI de vitamine D au début de chaque hiver à partir de l’âge de 2 ans et ceci jusqu’à l’adolescence. (5).
En somme, la supplémentation en vitamine D est essentielle pour maintenir une bonne santé osseuse, surtout pour ceux qui présentent un risque accru de carence.
Il est crucial de souligner que cette supplémentation ne doit pas remplacer un bon régime alimentaire riche en nutriments et une exposition quotidienne au soleil d’environ 10 minutes/jour. Ces pratiques complémentaires favorisent une absorption naturelle de la vitamine D et contribuent à un bien-être global.
Bibliographies:
- Cherifa A et coll “Impact of vitamin D supplementation model on the circulating levels of 25 (OH) D in Algerian children aged 1–23 months” The Journal of SteroidBiochemistryand Molecular Biology2020 ;196(105487) :0960-0760.
- Bacchetta J et coll “Vitamin D and calcium intakes in general pediatric populations ” A French expert consensus paper,Archives de Pédiatrie 2022 ; 29(04) : 312-325.
- ANSM “Vitamine D chez l’enfant : recourir aux medicaments et non aux complements alimentaires pour pr evenir le risque de surdosage “Mis à jour le 17 mars 2021 : 02 pages.
- “Apport de vitamine D Nouvelles recommandations” www.afpa.org consulté le 27/03/2022
- Ministère de la Santé avec appui de l’UNICEF ” carnet de santé” 2024

Dernière mise à jour : Mars 2025

Close up of female diabetes patient making subcutaneous insulin injection into her abdomen with insulin pen syringe for at home. Diabetes, health care and medical concept. Diabetes World Day.
L’insuline vous a été prescrite par votre médecin pour traiter votre diabète. C’est un traitement strictement personnel.
L’insuline est une hormone qui vous permettra de baisser votre taux de glycémie.
Pour assurer une bonne efficacité de votre insuline et d’équilibrer votre diabète ; vous devez suivre des recommandations d’administration :
- Où est-ce que j’injecte mon insuline ?
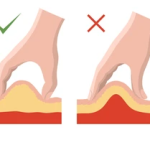
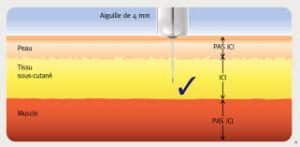 L’insuline doit être administrée par injection sous-cutanée (sous la peau) et non dans le muscle.
L’insuline doit être administrée par injection sous-cutanée (sous la peau) et non dans le muscle.
Le tissu sous-cutané est moins vascularisé , ce qui permet une libération lente de l’insuline
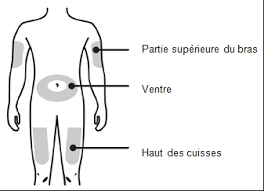
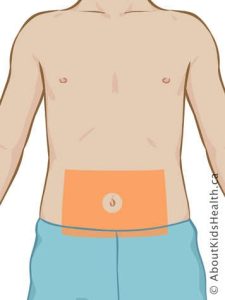
L’injection peut se faire au niveau de 4 zones : le ventre, les bras, les fesses et les cuisses.
Attention : Si vous avez injecté votre insuline dans le muscle, cela pourrait accélérer la libération de l’insuline dans le sang, ce qui pourrait provoquer une hypoglycémie. (Baisse de la glycémie en dessous de la normale).
Conseils :
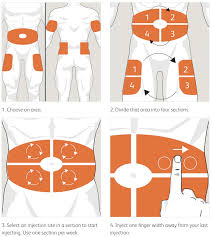
- A chaque zone d’injection à un horaire: réservez chaque zone pour un horaire précis :
Exemple : Le matin dans l’abdomen, le soir dans les cuisses.- Evitez de changer de zone à chaque injection
- Dans une même zone, il est préférable d’espacer les sites injections d’au moins 1 cm, les uns des autres.
- Il est possible de faire des rotations des points d’injection dans le sens d’une aiguille d’une montre, tel qu’illustré dans l’image
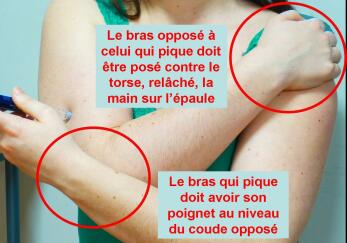
- Cas particulier : injection au niveau du bras :
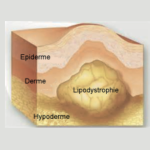
⇒ Une bonne injection vous permettra d’éviter la lipodystrophie
Qu’est-ce que les lipodystrophies ?
Les lipodystrophies sont des « bosses » de masse graisseuse sous cutanées induites par une mauvaise pratique d’injection.
Elles rendent la libération de l’insuline plus lente et donc un mauvais contrôle de la glycémie.
Il ne faut jamais injecter dans une lipodystrophie
- Comment injecter mon insuline ?
-
- Règles d’hygiène :
- Lavage des mains

- Propreté de la zone à injecter (si la zone est souillée ; lavez au savon et rincez à l’eau)
- Lavage des mains
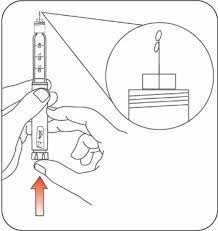
- Homogénéisez l’insuline laiteuse :
- Retournez le stylo 10 fois

- Vérifiez qu’elle soit homogène
- Retournez le stylo 10 fois
- Fixez l’aiguille sur le stylo :
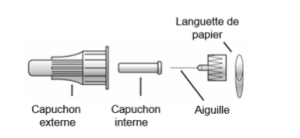

1 injection = 1 aiguille
- Effectuez une purge :
- Avant chaque injection, effectuez une purge, pour :
- Eliminer les bulles d’air
- Vérifier le bon fonctionnement du stylo
- Comment ?
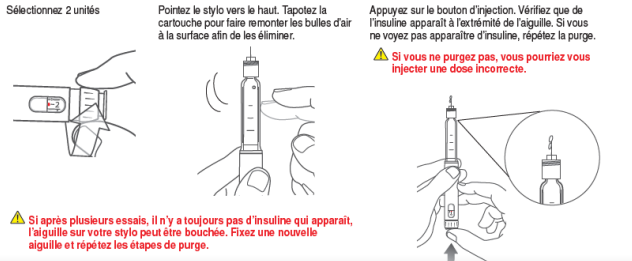
- Avant chaque injection, effectuez une purge, pour :
- Sélectionnez la dose à injecter :

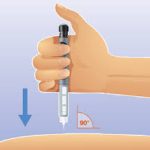
- Insérez l’aiguille dans la peau à 90° :
- Respectez le temps d’injection (10 secondes)
(Si une goutte perle sur votre peau, cela traduit que l’administration a été rapide, la quantité d’insuline injectée est donc diminuée)

- Retirez l’aiguille et jetez-la immédiatement.

- Règles d’hygiène :
Précautions générales :
- Pourquoi devez-vous utiliser une nouvelle aiguille à chaque injection ?
- Avoir une aiguille stérile à chaque utilisation
- Eviter d’avoir une aiguille bouchée par le reste d’insuline
- Avoir une aiguille bien aiguisée ce qui réduit la douleur
- Eviter la lipodystrophie

- Comment conserver le stylo à insuline ?
- Avant ouverture : 2-4° C
- Après ouverture : 4- 25° C pendant 1 mois.
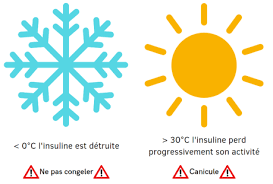
N’oubliez pas que si l’insuline est froide, l’injection est douloureuse.
Si vous avez le moindre problème avec le stylo à insuline (par exemple : blocage du stylo) , ou l’effet de l’insuline elle-même ; n’hésitez pas à vous rapprocher de votre médecin ou votre pharmacien pour nous transmettre votre déclaration.
Ou vous pouvez nous déclarer directement, en remplissant la fiche de déclaration téléchargeable sur notre site internet. www.cnpm.org.dz
Références :
OméDIT . Septembre 2023 « bon usage des insulines ». www.omedit-centre.fr
Service endocrinologie du centre hospitalier de Perpignan. Mai 2020. Les bonnes pratiques de l’utilisation des stylos à insuline. www.diabete66.fr
BD medical Unité Diabète. Mon guide de l’injection d’insuline. www.diabetebd.fr
La rachianesthésie estune technique d’anesthésie loco-régionale fréquemment utilisée en chirurgie, elle consiste à injecter un anesthésique local dans le liquide céphalorachidien (LCR) à travers l’espace intervertébral.
Le médicament anesthésiquevaagirlocalement sur les racines nerveuses médullaires (1).
Des céphalées peuvent survenir après une rachianesthésie appelées céphalées post-rachianesthésie(CPR). C’est une complication fréquente de la rachianesthésie et leur incidence varie entre 4,2 % et 11 % (2).
Physiopathologie des céphalées post-rachianesthésie :
La rachianesthésie peut être réalisée chez le patient en position assise ou en décubitus latéral.Après la désinfection du dos, on réalise d’abord une anesthésie locale de la peau avant de faire le geste puis on utilise une aiguille extrêmement fine, dont la pointe n’est pas traumatique pour les tissus et l’introduire entre deux vertèbres lombaires en dessous de la terminaison de la moelle épinière (1). Untel geste peut entrainer une perte de LCR dans l’espace péridural par le trou dural (brèche créée par l’introduction de l’aiguille) provoquant une chute de la pression du LCR et une hypotension intracrânienne.
La diminution du liquide céphalo-rachidien intracrânien entraine une traction sur les structures sensibles de la douleur et une augmentation du débit sanguin cérébral responsables des CPR (4).
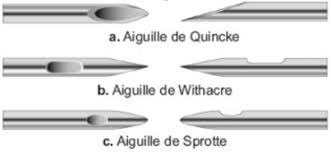
Il existe différents types d’aiguilles,
- Les aiguilles de Quincke,
- Les aiguilles de Sprotte,
- Les aiguilles de Withacre.
Les aiguilles de Quincke sont perforées à leur extrémité qui est taillée en biseau.
Les aiguilles de Sprotte et de Withacre ont une pointe non tranchante (en pointe de crayon) et l’orifice est situé tout près de l’extrémité, ces dernières aiguilles sont qualifiées d’«atraumatique».
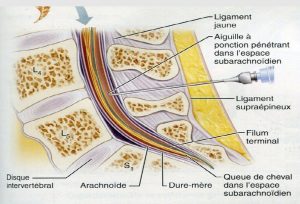
Ces caractéristiques jouent un rôle non négligeable dans la survenue des céphalées post-rachianesthésie. Ainsi, utiliser des aiguilles de rachianesthésie de petit diamètre et atraumatique entraine une diminution significative de l’incidence des CPR car la brèche est de plus petite taille (petite fuite de LCR) et les fibres constituant la dure mère sont séparées plutôt que sectionnées (5).
Caractéristiques cliniques des céphalées post-rachianesthésie :
Les céphalées post-rachianesthésie se développent dans les jours qui suivent le geste chirurgical. Elles sont caractérisées par :
- Leur intensité : les céphalées sont souvent intenses
- Leur caractère postural : elles s’aggravent en position assise et s’atténuent en position couchée
- Des douleurs cervicales peuvent être associées
- Une photophobie (6).
Les facteurs de risque reconnus des céphalées post-rachianesthésie sont : le sexe féminin, le jeune âge (20-30 ans), une faible masse corporelle, les aiguilles de large diamètre, lenombre d’essais pour localiser l’espace rachidien ou l’espace péridural expérience de l’opérateur.
Par contre, ni l’orientation du biseau de l’aiguille, ni la technique utilisée (abord médian ou para-médian) ne semblent influencer l’incidence des céphalées (5).
Diagnostic des céphalées post-rachianesthésie :
Le diagnostic des céphalées post rachianesthésie (CPR) est basé sur l’interrogatoire à la recherche d’une ponction durale documentée et une céphalée posturale sévère.
Un patient présentant des caractéristiques atypiques et inattendues de CPR graves nécessite une évaluation neurologique complète et un bilan radiologique (TDM, IRM) (4).
Le diagnostic différentiel de CPR comprend le sevrage de la caféine, les migraines, la méningite, la sinusite, la pré-éclampsie, la pneumocéphalie et les pathologies intracrâniennes telles qu’un hématome sous-dural et le syndrome d’encéphalopathie postérieure réversible (SEPR).
Traitement des céphalées post rachianesthésie :
- Mesures conservatrices :
La prise en charge conservatrice sous forme de thérapie de soutien comprend le repos au lit et la réhydratation. Ce traitement peut contrôler les symptômes mais n’apporte généralement pas un soulagement complet.
L’alitement, le décubitus dorsal et les ceintures abdominales peuvent n’avoir aucun avantage ou ne pas être pratiques dans le cadre d’une parturiente s’occupant d’un nouveau-né, et l’alitement prolongé n’est pas recommandé car il peut augmenter le risque de complications thromboemboliques (4).
- Traitement pharmacologique :
Les vasoconstricteurs cérébraux sont utilisés pour réduire les céphalées (exemple de la caféine) par leur effet sur les vaisseaux sanguins cérébraux dilatés.
La caféine orale est recommandée à la dose de 300 à 500 mg une ou deux fois par jour avec un maximum de 900 mg en 24 heures. La caféine intraveineuse peut être administrée si le patient est incapable de boire (4).
Les analgésiques (anti-inflammatoires non stéroïdiens tels que l’aspirine, l’acétaminophène et opioïdes oraux comme l’oxycodone) sont aussi indiqués pendant les premières heures.
D’autres médicaments sont utilisés avec des preuves d’efficacité insuffisantes, il s’agit de l’aminophylline, la théophylline, l’hormone adrénocorticotrope (ACTH), la desmopressine, l’hydrocortisone, la dexaméthasone, la méthylprednisolone, les triptans, les gabapentinoïdes, la méthylergonovine, l’ondansétron, le mannitol, la néostigmine et l’atropine (4).
- Traitement invasif : Blood Patch (BP).
Le traitement définitif des céphalées et/ou des troubles associés repose sur la réalisation d’un Blood Patch (BP) ou injection péridurale de sang autologue. La réalisation d’un BP est simple, il s’agit d’une injection péridurale de sang autologue, parfois désignée sous le terme de colmatage péridural, il est effectué dans des conditions strictes d’asepsie après repérage de l’espace péridural (7).
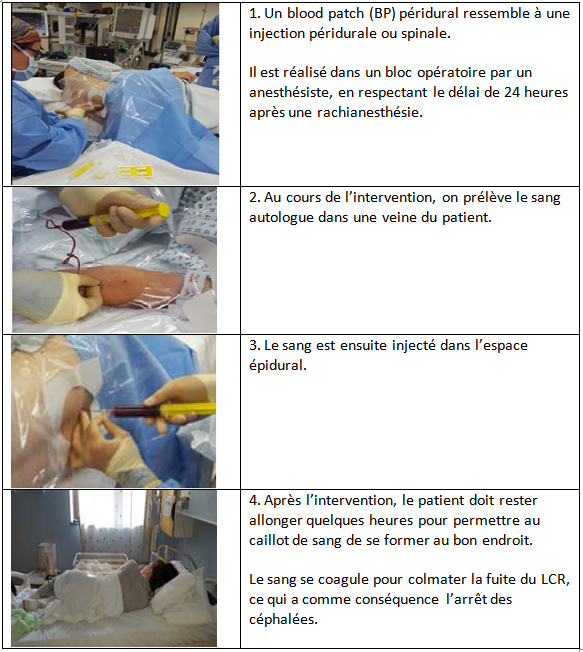
Lorsque la ponction durale est récente et le point de pénétration cutané est toujours visible et/ou lorsque l’étage intervertébral de ponction est connu, il est de bonne règle de pratiquer le BP au même niveau, voire au-dessous du niveau de la brèche. Lorsque de multiples ponctions ou tentatives de ponction ont eu lieu, il est préférable d’injecter le sang au niveau ponctionné le plus bas (7).
Contre-indications du Blood Patch :
Les contre-indications du Blood Patch sont rares, elles relèvent soit d’une contre-indication habituelle à l’abord péridural (troubles de l’hémostase), soit d’une contre-indication à l’injection de sang autologue (bactériémie, virémie).
Le refus du patient, qui doit avoir reçu une information adaptée, claire et loyale sur le BP, est une contre-indication formelle.
Il est également important, avant de réaliser un BP, d’éliminer les diagnostics différentiels qui sont la thrombose des veines corticales et la méningite. Au moindre doute, il faut avoir recours à l’imagerie médicale encéphalique et/ou lombaire afin d’affirmer le diagnostic (7).
Conclusion :
Les céphalées post-rachianesthésie sont fréquentes et peuvent être sévères. L’utilisation d’une aiguille atraumatique et de petit diamètre entraine une diminution significative de l’incidence des CPR. Leur prise en charge doit être rapide et efficace. Le traitement pharmacologique peut soulager le patient mais le recours aux techniques invasives tel que le Blood Patch s’avère parfois nécessaire.
Référence :
- Xavier P. “L’anesthésie loco-régionale : la rachianesthésie” » Chirurgynécol.Mam. de Charente. http://www.chirurgie-gynecologie.fr/page-anesthesie/anesthesie-locoregionale.html. Mise à jour le 15 Aout 2015.
- Nath S. et coll. ̎Atraumatic versus conventional lumbar puncture needles: a systematic review and meta-analysis ̎. The Lancet 2018. 391 :1197-204.
- Aubrun F. “Céphalées post-anesthésie” Le praticien en anesthésie-réanimation. 2004 ;8, Issue 3 : 183-191.
- Comité d’anesthésie obstétricale ̎Statement on Post-Dural PunctureHeadacheManagement ̎.Am Soc Anesthesiol 2021: https://www.asahq.org › files › standards-guidelines: 10 pages.
- Lenelle L. et coll. “Les céphalées post-ponction durale : traitement et prévention”Rev. Med. Liège 2011,66 : 11 : 575-580.
- Association d’anesthésie obstétricale “Maux de tête après une anesthésie péridurale ou une rachianesthésie ‒ ce qu’il faut savoir ?” Obstetanesthesistesassoc. 2016, http://www.labourpains.com: 05 pages.
- Viel E. et coll. “Céphalées positionnelles après anesthésie ou infiltration péridurale, rachianesthésie ou ponction lombaire : que faire ?”Correspondances en médecine – 4, (III) 2002. http://www.edimark.fr › Front › frontpost › getfiles : 04 pages.
Dernière mise à jour : Mars 2025
Les médicaments à base de valproate sont utilisés pour traiter l’épilepsie et les troubles bipolaires .
Le risque de malformations et des troubles de développement neurologique chez les enfants nés de mères traitées par ces médicaments lors de la grossesse a été confirmé. En effet, On estime que jusqu’à 30 à 40 enfants d’âge préscolaire sur 100 dont les mères étaient sous traitement à base de valproate pendant la grossesse peuvent avoir des problèmes de développement dans la petite enfance, comme l’acquisition lente de la marche et la parole, des capacités intellectuelles inférieures à celles des autres enfants et des difficultés de langage et de mémoire.
Mais qu’en est-il du risque de troubles du développement neurologique chez les enfants nés de père traité par les médicaments à base de valproate ?
le PRAC (Pharmacovigilance Risk Assessment Committee ) a examiné les données d’une étude observationnelle rétrospective , à la suite d’une évaluation antérieure de l’utilisation du valproate pendant la grossesse.
Le Comité a également examiné les données d’autres sources, notamment des études non cliniques (en laboratoire) et des publications scientifiques, et a consulté des patients et des experts cliniques.
L’étude observationnelle rétrospective s’est déroulée au Danemark, en Norvège et en Suède et s’est concentrée sur les résultats de la naissance d’enfants nés de pères traités par le valproate, la lamotrigine ou le lévétiracétam moment de la conception.
Les résultats de l’étude suggèrent qu’il pourrait y avoir un risque accru de troubles du développement neurologique chez les enfants nés de père ayant pris du valproate dans les 3 mois précédant la conception. Les troubles du développement neurologique se manifestent dès la petite enfance, tels que des troubles du spectre autistique, la déficience intellectuelle, les troubles de la communication, un déficit de l’attention et d’hyperactivité et les troubles du mouvement.
Les données ont montré qu’environ 5 enfants sur 100 souffrent d’un trouble neurodéveloppemental lorsque les pères sont traités au valproate, contre environ 3 sur 100 lorsque les pères sont traités à la lamotrigine ou au lévétiracétam. L’étude n’a pas examiné le risque chez les enfants nés de père ayant arrêté de prendre du valproate plus de 3 mois avant la conception.
Des mesures de précaution doivent , donc, être prises pour les patients traités par des médicaments à base de valproate pour remédier à un risque potentiellement accru de troubles du développement neurologique chez les enfants nés de pères traités par valproate au cours des 3 mois précédant la conception.
Le CNPM recommande aux médecins d’informer les patients des deux sexes hommes et femmes en âge de procréer et traités par le valproate, des risques possibles de déficit et de malformation neurologique de leur progéniture et de discuter la nécessité d’une contraception efficace, pour les deux.
Et une réévaluation régulière pour déterminer si le traitement à base de valproate est le plus adapté, en particulier lorsque le patient projette de concevoir un enfant.
Le CNPM recommande de mentionner ce risque dans les des RCP (résumé des caractéristiques du produit) des médicaments à base de valproate.
Références bibliographique :
https://catalogues.ema.europa.eu/node/3611/administrative-details
L’hydroxyde ferrique saccharose est une solution injectable de fer indiqué dans le traitement des anémies ferriprives lorsque le traitement en fer par voie orale est insuffisant, mal toléré ou n’est pas adapté.
La perfusion de ce médicament estsusceptible d’entrainer des réactionsd’hypersensibilité qui peuvent être fatales et peuvent se produire même si une administration précédente avait été bien tolérée.Les réactions anaphylactiquessont très rares, leur mécanisme est celui d’une activation anormale du complément, possiblement liée à des anticorps non-IgEdirigés contre les groupements carbohydrates (contenue dans le saccharose) qui stabilisent la formulation de fer (1).
L’évaluation de la balance bénéfices/risques des médicaments injectables à base de fer mentionne des avantages l’emportant sur lesrisques encourus, à condition que des mesures adéquates soient prises pour minimiser la survenue de réactions allergiques (2).
Durant la grossesse, les réactions allergiques sont particulièrement préoccupantes car elles peuvent mettre en danger à la fois la mère et Le fœtus.Chez la femme enceinte, il y’a un risque d’hypertonie intra-utérine pouvant être à l’origine d’une anoxie fœtale, de détresse et de mort in utéro (3).
Afin de minimiser la survenue de ces réactions allergiques, l’évaluation de la balance bénéfices-risques des médicaments injectables à base de fer ainsi que l’application des recommandations d’utilisation sont de rigueur.
Les recommandations d’utilisation du fer injectable chez la femme enceinte sont :
- Les médicaments contenant du fer administré par voie intraveineuse ne doivent pas être utilisés pendant la grossesse sauf en cas de nécessité absolue.
- Lorsque le bénéfice est estimé supérieur au risque pour la mère et le fœtus, le traitement doit être limité au deuxième ou troisième trimestre de grossesse.
- En dehors de la grossesse, des recommandations d’utilisation de l’hydroxyde ferrique saccharose ont déjà été émises par le CNPM que vous retrouverez sur son site (cnpm.org.dz).
Références Bibliographiques :
- Moi L. et al. ‟Réactions d’hypersensibilité au fer intraveineux : le point de vue de l’allergologue”. RevmedCh. 06 Avril 2022 ; N° 776.
- EMA. ‟Intravenous iron-containing medicinal products: New recommendations to manage the risk of allergic reactions” September 2013.
- ANSM. ‟Spécialités à base de fer pour injection intraveineuse : une utilisation réservée aux établissements de santé en raison du risque de réactions graves d’hypersensibilité, Point d’information”. 6 novembre 2013.
Dernière mise à jour : Mars 2025
Les patients atteints de maladies autoimmunes (MAI) présentent classiquement un risque accru d’infections attribué à la maladie en tant que telle, mais aussi aux traitements immunosuppresseurs (IS) et aux comorbidités(1).
Les liens entre la Covid-19 et les maladies inflammatoires auto-immunes sont nécessairement compliquées. En effet, il est admis que la première peut dans ses formes graves s’accompagner d’une inflammation liée à un orage cytokinique, ce qui a conduit à tester certains médicaments contre l’inflammation (dont l’hydroxychloroquine et des anti Il6) dans cette maladie (3) .
D’autre part les pathologies inflammatoires auto-immunes devraient, puisqu’elles sont inflammatoires, aggraver le pronostic d’une Covid sévère (sauf peut-être si elles sont traitées par les anti inflammatoires suscités) mais aussi favoriser l’infection par le SARS-CoV-2 en cas d’administration de biothérapies et d’immunosuppresseurs qui diminuent les défenses immunitaires un tableau à double entrée, avec risque d’augmentation de l’incidence et de la gravité (3).
Les données disponibles ce jour sur les facteurs de risque de complications liées au COVID-19 sont rétrospectives. La documentation de l’historique des patients est par ailleurs souvent incomplète, avec un manque d’information concernant la présence d’une MAI et d’une IS(1).
À ce jour il n’y a pas suffisamment de données pour utiliser des traitements immunomodulateurs à visée prophylactique contre le COVID-19 et les patients sous hydroxychloroquine ne peuvent pas être considérés comme protégés(1).
La prise de corticoïdes au long cours à forte dose par voie orale rend plus fragile vis-à-vis du virus SARS-CoV-2. Les traitements de fond les plus fréquemment utilisés comme le méthotrexate, les anti-TNF, les anti-interleukine-6, ne semblent pas s’accompagner d’un risque élevé d’infection sévère au SARS-CoV-2 (2).
D’autres traitements de fond diminuent les défenses immunitaires et pourraient contribuer à rendre plus fragile vis-à-vis du virus SARS-CoV -2 notamment : le rituximab, le cyclophosphamide, l’azathioprine, le mycophénolate mofétil etc (2)
Pas d’arrêt intempestif des traitements immunosuppresseurs/immunomodulateurs et biothérapies, sauf en cas de signes d’infection (fièvre, toux, difficultés respiratoires, courbatures…) et uniquement sur avis médical du médecin référent qui suit la pathologie ou le médecin de famille(2)
Ne pas arrêter brutalement non plus les corticoides,la colchicine pour les maladies auto-inflammatoire ainsi que l’hydroxychloroquine , ce dernier n’a montré aucun intérêt dans le traitement des symptômes de la COVID-19 mais a par contre montré tout son intérêt dans le traitement du lupus notamment.
Les facteurs de risque déjà identifiés dans la population générale restent ceux le plus souvent associés à un risque de forme sévère chez les patients atteints de maladies auto-immunes et autoinflammatoires à savoir : l’âge avancé, l’obésité,diabète non équilibré,antécédents d’HTA d’AVC etc (2).
Concernant la vaccination contre la COVID-19, il est recommandé de vacciner les patients atteints de rhumatismes inflammatoires et de maladies auto-immunes systémiques (4).
L’efficacité de la vaccination anti-Covid-19 chez ces patients a été démontrée bien que celle-ci soit légèrement inférieure à celle des personnes saines. Plusieurs études ont permis de démontrer la bonne tolérance à la vaccination des patients atteints de maladies auto-immunes dont le lupus , les maladies rhumatismales et les maladies rénales à médiation immunitaire (5), pour ces patients il est préférable d’utiliser les vaccins à ARNm (5) .
En cas de maladies chroniques en poussée, reporter de 2 à 4 semaines la vaccination(6).
Les patients sous traitement immunosuppresseur ou sous corticoïdes à doses immunosuppressives, peuvent ne pas développer une réponse immunitaire suffisante. Les traitements immunosuppresseurs ne doivent pas être administrés un mois avant et jusqu’à un mois après le vaccin (6).
Les vaccins anti covid utilisés de nos jours, n’ont pas été développés à partir d’un vaccin vivant atténué, de ce fait, il n’est pas recommandé d’arrêter un traitement de fond conventionnel (4).
Conclusion :
Compte tenu du caractère pandémique de la covid 19, les patients atteints de maladies auto-immunes sont à risque de contracter l’infection comme tout un chacun, leur prise en charge reste délicate et dépend de la pathologie auto-immune, du traitement de fond et des co-morbidités
Ces malades doivent respecter strictement les mesures de protection adressées à l’ensemble de la population
Bibliographie :
- Horisberger A et Coll ” Service d’immunologie et allergologie, Département de médecine interne “, Rev Med suisse DOI: 10.53738/REVMED.2020.16.691.0 consultée le 21/08/2022
- FAI R et coll ” la filière de santé des maladies auto-immunes et auto-inflammatoires rares “, https://www.fai2r.org actualite covid 19: 28 Juin 2022
- Haberman R et coll ” Covid 19 in Immune-Mediated Inflammatory aricle” com/archives/328 2020
- Société française de rhumatologie (SFR) ” recommandation de la SFR pour la vaccination anti covid 19 des patients atteints de maladies inflammatoires ” 2021
- ” Vaccination des personnes atteintes de maladies auto-immunes (Conseil d’Orientation de la Stratégie Vaccinale) ” Ministère de la santé France « Note du 26 novembre 2021 »
- ” Protocole de la vaccination COVID19 en Algérie” Comité technique national consultatif sur la vaccination Ministère de la santé 2021.
Dernière mise à jour : Novembre 2022
Le syndrome métabolique regroupe un ensemble d’anomalies cliniques (Surpoids abdominal, HTA) et biologiques (hyperglycémie, hyperlipidémie) exposant à un risque accru de diabète de type 2 et d’affections cardiovasculaires (coronaropathies, AVC) (1).
L’utilisation de certains médicaments peut augmenter le risque de développement du syndrome métabolique soit en favorisant la prise de poids, soit en altérant le métabolisme des lipides ou du glucose (2). La mise en évidence des médicaments couramment utilisés qui peuvent augmenter le risque de syndrome métabolique permet de reconnaître et comprendre le risque associé à ces derniers et surveiller de manière appropriée les changements liés au syndrome métabolique.
– Des antihypertenseurs: les diurétiques et Bétabloquants (βB)
Outre leur mode d’action hypotenseur, ils diffèrent par leur activité endocrinienne et métabolique. Il est admis que les IEC, les sartans et les anticalciques n’ont pas d’effet significatif sur les lipides sanguins (peut être en partie par la sécrétion d’adiponectine[1]), alors que les diurétiques thiazidiques, les diurétiques de l’anse et les βB ont un effet délétère (3) qui s’expriment par :
- Une insulino-résistance (2,3) ;
- Une augmentation du cholestérol total et du LDL-C (2,3) ;
- Une hypertriglycéridémie (2,3) ;
- Une baisse des taux du HDL-C (2,3).
– Contraceptifs Oraux :
Les œstrogènes et les progestatifs androgéniques ont un effet dose-dépendant sur la tolérance au glucose avec un plus grand impact pour les progestatifs (2).
L’influence des contraceptifs oraux sur le taux des lipides plasmatiques dépend de la dose d’œstrogènes et du caractère androgénique plus ou moins marqué du progestatif (4) :
- Les œstrogènes augmentent les triglycérides sériques et le HDL-C et abaissent les niveaux de LDL-C (2,4).
- Les progestatifs androgéniques augmentent le LDL-C sérique et diminuent le HDL-C (2,4).
Mieux vaut conseiller des évaluations des profils lipidiques aux femmes sous contraceptifs oraux, et particulièrement aux femmes présentant d’autres facteurs de risque pouvant augmenter le risque de développement d’un syndrome métabolique.
– Des antipsychotiques atypiques:
La prévalence de l’obésité et du diabète chez les patients atteints de maladies psychiatriques est deux à quatre fois plus élevée que dans la population générale (5). Un mécanisme a été évoqué ; activation des neurones orexigènes hypothalamiques, agissant sur la stimulation de l’appétit par les antipsychotiques (6). Ainsi, le risque de prise de poids sous antipsychotiques atypiques est plus important par rapport à un traitement par antipsychotiques classiques exposant le patient à un syndrome métabolique sans que ce soit dose-dépendant (6).
En pratique, lors d’une augmentation égale ou supérieure à 5% du poids initial, ou en cas d’altérations significatives et durables de la glycémie et/ou du profil lipidique chez les patients sous antipsychotiques, instaurer des mesures d’hygiène de vie (régime, activité sportive, consultation diététique). Lors de telles altérations, la balance risques/bénéfices du traitement doit aussi être réévalué (par exemple, risque de rechute de la maladie psychiatrique versus risque cardiovasculaire à long terme) afin d’évaluer l’indication d’un changement de médication (5).
– Les Corticoïdes :
Les corticoïdes sont efficaces dans le traitement de nombreuses maladies systémiques, cependant ils peuvent être à l’origine de complications métaboliques et cardiovasculaires (7).Les glucocorticoïdes sont bien reconnus pour leur potentiel diabétogène (diabète cortico-induit), L’augmentation du poids corporel, le risque d’hypertension artérielle et leur effet sur le métabolisme lipidique (2). Le syndrome métabolique rencontré avec la prise de corticoïde est lié à plusieurs mécanismes :
- Une altération directe de la sécrétion d’insuline par effet toxique des corticoïdes sur les cellules β pancréatiques (9) ;
- Une insulino-résistance à trois niveaux : le foie, le muscle squelettique (translocation GLUT4[2] diminuée) et l’adipocyte (9) ;
- Une néoglucogenèse hépatique accrue (2,8) ;
- Protéolyse et lipolyse (9).
Le risque de syndrome métabolique est dose dépendante et temps dépendant, d’autres facteurs de risques existent notamment (9) :
- Doses élevées de corticoïdes : prednisolone >20 mg, hydrocortisone >50 mg, dexamethasone >4mg ;
- Surpoids ou obésité ;
- Diabète de Type 1 (DT1) ou Diabète de Type 2 (DT2) préexistant ou Diabète lors d’une corticothérapie antérieure ;
- Antécédent de diabète gestationnel (ou poids de naissance > 4 kg) ;
- Antécédents familiaux de DT2 ;
- Age > 45 ans ;
- Prédiabète (HbA1c entre 5,7 et 6,4 % et/ou glycémie à jeun entre 1,10 et 1,25 g/l) ;
- Immunosuppresseur associé ;
- Syndrome des ovaires polykystiques.
– Des immunosuppresseurs :
La cyclosporine et le tacrolimus sont des agents immunosuppresseurs utilisés pour prévenir le rejet d’organe post-transplantation. Les cyclosporines peuvent provoquer une hyperglycémie par des effets toxiques sur les cellules β ou par le développement d’une insulino-résistance à l’origine d’une hyperglycémie, une intolérance au glucose et un DT2 (l’effet sur le métabolisme des glucides semble être dose-dépendant).
Par ailleurs, le mécanisme sous-jacent au développement du diabète ou d’un syndrome métabolique avec le tacrolimus n’est pas clair alors que le syndrome métabolique est le plus souvent observé avec le tacrolimus qu’avec la cyclosporine (2).
– Des antirétroviraux :
Les traitements antirétroviraux se compliquent fréquemment d’effets indésirables de type lipodystrophie, d’une altération de la répartition du tissu adipeux (lipoatrophie périphérique et hypertrophie centrale), et/ou de troubles métaboliques : insulino-résistance, dyslipidémie et plus rarement troubles de la tolérance au glucose, voire diabète (2). Les deux classes de molécules antirétrovirales les plus utilisées ont été incriminées : analogues nucléosidiques (INTI) et inhibiteurs de la protéase virale (IP) (2) par des mécanismes différents mais qui convergent sur le tissu adipeux. Certaines des molécules de ces deux classes modifient profondément la différenciation des cellules adipeuses, leurs métabolismes, leur fonction mitochondriale et l’équilibre des hormones (leptine, adiponectine) et cytokines (TNFα, IL-6) qu’elles sécrètent (10).
Conclusion :
Le syndrome métabolique induit par les médicaments est une réalité. Alors que le mécanisme était largement méconnu, il est illusoire aujourd’hui de pouvoir prédire le risque métabolique et cardiovasculaire associé à un médicament en fonction de son profil réceptoriel. En vue de l’irréversibilité de cet effet indésirable, la surveillance étroite pendant le traitement, devra porter sur le poids, la glycémie, la pression artérielle et le bilan lipidique. Cette surveillance dépend des facteurs de risque trouvés avant l’instauration du traitement, des signes cliniques apparaissant pendant le traitement, et du traitement instauré (11).
Les professionnels de la santé doivent porter une attention particulière au choix des médicaments chez les patients en surpoids ou présentant d’autres facteurs de risque de diabète ou de maladies cardiovasculaires. Les effets sur le métabolisme lipidique et sur la glycémie peuvent diminuer l’adhérence au traitement. A cet égard, l’analyse du rapport bénéfices/risques dans l’utilisation de ces médicaments se révèle souvent délicate, nécessitant une approche multidisciplinaire impliquant médecins généralistes, psychiatres, endocrinologues, pharmacologues, cardiologues et diététiciens.
Référence :
- Delarue et coll. ” Le syndrome métabolique” VIe Symposium nutrition « Intervention nutritionnelle : de la prévention à la thérapeutique » – Brest, octobre 2005.
- Marion R. et coll. ‟ Drug Induced Metabolic Syndrome” J Clin Hypert. 2006; 8 (2): 114-119.
- Martin R. et coll. “Effets endocriniens et métaboliques des antihypertenseurs : effets pléiotropes et conséquences dans le syndrome métabolique”. Rev Med Suisse 2007 ; 3 : 681-691.
- Pierre G. et coll. “Contraception hormonale chez la femme à risque vasculaire et métabolique: Recommandations de la Société française d’endocrinologie” https://www.sfendocrino.org/_images/mediatheque/articles/pdf/recommandations/2010%20consensus_sfe_2010_contraception_hormonale_vd.pdf. Consulté le 01 Aout2022 : 53 pages.
- E et coll. “Suivi du syndrome métabolique induit par les antipsychotiques atypiques : recommandations et perspectives pharmacogénétiques”. Rev Med Suisse 2008 ; 4 : 1994-1999.
- Winterfeld U et coll. ‟ Effets indésirables métaboliques en pédopsychiatrie ” Pharmactuel. 2009 ; 42 (2) : 5 pages.
- Bestaoui M.H et coll. “Effets des glucocorticoïdes au cours des maladies systémiques sur les paramètres du syndrome métabolique” Rev Rhumatisme 2021 ; 88, Supplément 1:A189.
- Genolet P. et coll. “Diabète cortico-induit, une entité fréquente sans prise en charge standardisée” Med Suisse 2012; 8 : 800-805.
- Bastin et coll. “Diabète et corticoïdes : nouveautés et aspects pratiques” Rev Med Interne 2020 : 10 pages.
- Capeau J. et coll. “Les lipodystrophies secondaires aux traitements antirétroviraux de l’infection par le VIH” Med Sci 2006 ; 22 : 531–536.
- Rallo P. “Risque de syndrome métabolique sous médicaments neuroleptiques, rôle à jouer par le pharmacien”. Thèse en vue d’obtention de diplôme en Sciences pharmaceutiques. 2022 :112 pages.
[1] L´adiponectine est une hormone, sécrétée par les adipocytes, qui joue un rôle majeur en tant qu´adipokine antidiabétique et antiathérogène en améliorant l’entrée cellulaire du glucose et l’oxydation des acides gras au niveau des muscles et du foie. Les concentrations d´adiponectine sont diminuées dans l´obésité, l´insulinorésistance et le diabète de type 2.
[2] GLUT4 : Le transporteur de glucose 4′ (GLUT4) est une protéine de la famille des transporteurs GLUT de classe I.
Dernière mise à jour : Octobre 2022
Les surdités, sont des affections fréquentes, liées à l’atteinte d’une ou plusieurs structures de l’oreille. Les pertes d’audition augmentent avec l’âge, affectant moins de 5% des personnes âgées de 21 ans à 34 ans, et environ 45% des personnes âgées plus de 65 ans (1).
Les surdités sont classées en trois catégories selon le ou les segments de l’oreille atteint(s) à savoir (1, 2) :
- Les surdités de transmission: Elles sont liées à des atteintes de l’oreille externe ou de l’oreille moyenne.
- Les surdités de perception des signaux nerveux: Elles sont liées à des atteintes de l’oreille, du nerf auditif, ou rarement, du centre de l’audition, situé au niveau du système nerveux central.
- Les surdités mixtes associant surdités de transmission et de perception.
Les pertes d’auditions peuvent être uni ou bilatérales, d’apparition progressive ou brutale.
Les surdités liées au vieillissement sont les plus fréquentes, mais plusieurs causes peuvent être à l’origine de pertes d’audition à savoir (1) :
- Les anomalies congénitales: certaines surdités sont associées à des maladies génétiques tels que la trisomie 21, les ostéocléroses[1]٭, les mucopolysaccharidoses, les neurofibromatoses[2]٭.
- Les complications périnatales de la prématurité: l’acidose et l’hypoxie.
- Les infections: les otites infectieuses externes ou moyennes, les méningites bactériennes, des cochléites virales, des méningo-encéphalites, la rougeole et les oreillons.
- Les tumeurs bénignes ou malignes de l’oreille.
- Les troubles métaboliques ou endocriniens: diabète sucré, troubles thyroïdiennes.
- Les maladies auto immunes: lupus érythémateux, sclérose en plaques, etc.
- Les toxiques: des métaux lourds (arsenic, cadmium, mercure et dérivés, plomb), le bromate de potassium, le cobalt, des éthers de glycol, le toluène, la cocaïne (voie endonasale).
- Les causes iatrogènes: la radiothérapie, certaines interventions de l’oreille.
- Les traumatismes.
De nombreux médicaments, très variés peuvent être aussi en cause. Ils ont le plus souvent une toxicité directe sur l’oreille interne ou sur les nerfs auditifs, entrainant une surdité de perception unilatérale ou bilatérale. Le délai de survenue d’une ototoxicité médicamenteuse varie selon le médicament, allant de quelques heures ou quelques jours, jusqu’à plusieurs années après le début du traitement (1, 2, 3).
Cette ototoxicité dépend souvent de la dose de médicament et de la durée d’exposition. Les pertes d’audition s’aggravent parfois quand la prise du médicament est poursuivie et même après son arrêt. Une perforation du tympan augmente le risque de surdité irréversible, en cas d’utilisation de gouttes auriculaires contenant des substances ototoxiques (1,3).
Il existe des facteurs qui augmentent le risque de surdité liée au médicament à savoir (1,3) :
- L’âge des patients : le jeune âge ou le grand âge.
- La déshydratation.
- La diminution de l’élimination du médicament, notamment lors de l’insuffisance rénale.
- L’administration de fortes doses du médicament et/ou une administration rapide.
- L’association avec d’autres médicaments ototoxiques.
Les médicaments les plus souvent incriminés dans la perte d’audition sont les suivants (1,3,4) :
| Classe médicamenteuse | Médicament | |
|---|---|---|
| Des antibiotiques | Des aminosides | La gentamicine, la streptomycine, l’amikacine, la néomycine, la tobramycine, la kanamycine. |
| Des macrolides | L’erythromycine, l’azithromycine. | |
| Des cyclines | La minocycline. | |
| Des Glycopeptides | La vancomycine, la teicoplanine. | |
| Des polypeptides | La polymyxine B. | |
| Les céphalosporines | Le ceftriaxone. | |
| Des antifongiques | L’amphotéricine B, la griséofulvine, l’itraconazole. | |
| Des interférons | Le bocéprévir, l’interféron B. | |
| Des médicaments cardiovasulaires | Les diurétiques de l’anse | Le férosumide, le bumétadine. |
| Un inhibiteurde l’enzyme de conversion | Le ramipril. | |
| Des antiarythmiques | La quinidine, l’hydroquinidine. | |
| Des anti-inflammatoires non stéroïdiens | L’aspirine, le célécoxib, l’ibuprofene, naproxène,etc,,. | |
| Des médicaments des troubles de l’érection(les inhibiteurs de la phosphodiestérase de type 5). | Le sildénafil, le tadalafil, le vardénafil. | |
| Des antipaludiques | La quinine, la chloroquine, la méfloquine, l’arthéméther. | |
| Des immunodépresseurs | La thalidomide, le muromona-CD3, le tacrolimus, l’éfalizumab, la chloroquine, l’hydroxychloroquine. | |
| Des anticancéreux | Le cisplatine, la carboplatine, la vinblastine, la vincristine, le mifamurtide, la chlorméthine le docétaxel, le nilotinib, l’erlotinib, le thalidomide, le bortézomib. | |
| Des antalgiques | Le protoxyde d’azote. | |
| Des neuropsychotropes | L’acide valproïque, le flumazénil. | |
| Des disphosphonates | L’acide pamidronique, l’acide étidronique. | |
| Un hypouricémiant | Le fébuxostat. | |
| Des médicaments chélateurs de fer | Le déférasirox, le défériprone, la déferoxamine. | |
Remarque : L’association de plusieurs médicaments exposant à des surdités majore ce risque.
En pratique. La prescription d’un médicament qui expose à des surdités nécessite la prise en compte des facteurs de risque et l’information des patients de cet effet indésirable afin qu’ils soient attentifs aux signes évocateurs (pertes d’audition, acouphènes ou vertiges).
Bibliographie :
- ʺPertes d’audition d’origine médicamenteuse˝. Rev Prescrire 2014; 34 (368) : 428-435.
- ʺComprendre les différents types de surditésʺ. https://www.lescentresmasliah.com. Mise à jour le 15 Juin 2017 : 01 page.
- Réseau français des centres régionaux de pharmacovigilance RFCRPV. ″Médicaments et troubles de l’audition″. Mise à jour le 06 Février 2020 : 03 pages.
- ʺOtotoxicité médicamenteuse″. https://www.em-consulte.com. Mise à jour le 08 Aout 2012 : 01 page.
Dernière mise à jour : Septembre 2022
La lévothyroxine est un médicament utilisé dans le traitement de l’hypothyroïdie primaire et secondaire. Elle est généralement prise par voie orale à jeun. La quantité de thyroxine absorbée passe de 80% à jeun à 60% en cas d’administration avec les aliments (1) entraînant une absorption incomplète de la lévothyroxine avec des niveaux de TSH sériques généralement plus élevés.
Sur le Résumé des Caractéristiques des produits (RCP) , il est recommandé de prendre la lévothyroxine en une seule prise le matin à jeun une demi-heure avant le petit déjeuner (2), mais les recommandations standards indiquent que la lévothyroxine doit être prise une heure avant le petit déjeuner à jeun, pour éviter toute interférence de son absorption par les aliments ou les médicaments (3).
Le jeûne islamique[1] fournit un modèle unique de jeûne quotidien intermittent d’un point de vue physiologique (4). Aucune altération significative des concentrations sériques des T4, T3, TSH et TSH à la stimulation de la TRH n’a été observée dans l’organisme au cours du jeûne islamique, ce qui n’est pas le cas du jeûne expérimental[2] où on assiste à une diminution des taux sériques de la TSH et une baisse de la réponse de la TSH à la stimulation par la TRH (5). Notant bien qu’aucun changement dans l’élimination des hormones thyroïdiennes au cours des 24 premières heures n’a été observé lors du jeûne expérimental (5), on peut conclure qu’il ne devrait pas être nécessaire de modifier la posologie de la lévothyroxine pendant le jeûne du Ramadan.
Les données liées aux variabilités de la prise de la lévothyroxine pendant le jeûne islamique sont rares (5). Les facteurs qui modifient l’absorption, le métabolisme et l’élimination des hormones thyroïdiennes pendant le Ramadan doivent être soigneusement pris en compte par les patients et les médecins. On suppose, que pendant le mois de Ramadan, des changements dans la motilité gastrique (en raison d’un jeûne prolongé), une interférence avec des repas copieux, une altération possible du rythme circadien pourraient altérer le métabolisme de ce médicament dans le corps (5).
Sur la base des informations ci-dessus, la bonne administration de la lévothyroxine pendant le Ramadan est obtenue lorsqu’elle est prise soit une heure avant la rupture du jeun (repas pris après le coucher du soleil) ou une heure avant Sehur (repas pris avant l’aube); cependant, la plupart des patients ont du mal à attendre 1 heure pour prendre leur repas d’Iftare ou à se réveiller avant Sehur et donc, risquent de manquer la dose ou la prendre avec le repas (5).
Bien que la prise de lévothyroxine entre ou avec les repas ne soit peut-être pas la meilleure solution durant le mois sacré, la prendre au coucher est une autre option, deux études ont montré qu’elle avait presque le même effet que lorsqu’elle était prise à jeun (6,7), c’est-à-dire que la diminution des taux de la TSH est presque identique (sinon meilleur). Cependant, le patient ne doit pas prendre de nourriture pendant au moins 2 heures avant le coucher.
En conclusion, les changements des taux d’hormones thyroïdiennes sériques et, par conséquent, des concentrations de TSH pendant le jeûne islamique sont en général minimes et n’altèrent pas la santé des personnes qui jeûnent. Le jeûne du Ramadan en soi n’entraîne aucun besoin de modification de la posologie de la lévothyroxine chez les patients hypothyroïdiens, d’autres facteurs nécessitent une modification de la dose de lévothyroxine, notamment la distance entre l’ingestion du médicament et le dernier repas et/ou le prochain repas doivent être pris en considération. Les patients qui ne peuvent attendre 1 heure après la prise de la lévothyroxine pour prendre leurs repas pourraient la consommer au couché à conditions de respecter 2 heures d’intervalle au minimum entre le dernier repas et la prise du médicament.
Référence :
- Fish LH et Coll. ʺReplacement dose, metabolism, and bioavailability of levothyroxine in the treatment of hypothyroidism: Role of triiodothyronine in pituitary feedback in humansʺ Engl J Med 1987; 316 (13): 764-770.
- ANSM. RCP Levothyrox 100 microgrammes comprimé sécable. Mis à jour le : Septembre 2019 consultée le Avril 2020.
- Biondi B et Coll. ̏ Treatment with thyroid hormoneʺ Rev Endocr 2014; 35 (3):433-512.
- Azizi F ̏ Islamic fasting and healthʺ Ann Nutr Metab 2010; 56 (4):273-282.
- Azizi F ʺI slamic Fasting and Thyroid Hormonesʺ Int J Endocrinol Metab 2015; 13(2): 29248.
- Bolk N et Coll. ̏ Effects of evening versus morning thyroxine ingestion on serum thyroid hormone profiles in hypothyroid patientsʺ Clin Endocrinol (Oxf) 2007; 66 (1):43-48.
- Rajput R et Coll. ̏ Can Levothyroxine Be Taken as Evening Dose? Comparative Evaluation of Morning versus Evening Dose of Levothyroxine in Treatment of Hypothyroidismʺ J Thyroid Res 2011; 2011:5.
[1] – Le jeûne dans l’islam, désigne une pratique musulmane consistant à s’abstenir de manger, de boire, depuis l’aube jusqu’au coucher du soleil.
[2] Le jeûne expérimental ou jeûne thérapeutique consiste à s’abstenir de tout aliment (solide ou liquide) à l’exception de l’eau pendant une période plus ou moins longue afin d’améliorer sa santé, soit pour diminuer les symptômes de maladies, soit pour les prévenir.
Dernière mise à jour: Septembre 2020
La gastroparésie est un trouble fonctionnel digestif caractérisé par un ralentissement objectif de la vidange gastrique, en l’absence de tout obstacle mécanique organique (1).
Le traitement de la gastroparésie repose en premier lieu sur les règles hygiéno-diététiques et les prokinétiques* usuels (Métoclopramide, Dompéridone). La gastroparésie peut relever de causes multiples mais elle est dans plus d’un tiers des cas idiopathique. Parmi les principales causes, le diabète, une chirurgie gastrique ou œsophagienne antérieure. Les médicaments peuvent etre aussi en cause (par atteinte neurologique) notamment : les anticholinergiques, les opioïdes, les antidépresseurs, les phénothiazines, la L-Dopa, etc… (2).
La gastroparésie affecte la biodisponibilité des médicaments, et notamment celle des prokinétiques à l’origine d’échec thérapeutique (3). Il serait utile de recourir à des prokinétiques absorbés soit par voie sublinguale (Dompéridone lyophilisat oral), soit par administration rectale (forme pédiatrique du Métoclopramide).
L’érythromycine constitue un autre recours thérapeutique en l’absence des deux alternatives précédentes ; l’érythromycine à une action « motilin-like », elle augmente la vidange gastrique. L’érythromycine peut causer des effets indésirables, notamment la tachyphylaxie (4) qui atténue son effet prokinétique lors d’une utilisation à moyen ou long terme. Cet effet résulte d’une désensibilisation des récepteurs gastro-intestinaux à la motiline.
En pratique : La gastroparésie est une entité probablement sous estimée. Le problème est surtout thérapeutique car les agents pharmacologiques ont une efficacité inconstante notamment sur le long terme. Un traitement discontinu par érythromycine avec des cures séquentielles de prokinétiques d’une autre classe peut limiter ce phénomène de tachyphylaxie (5).
Prokinétiques* : médicament qui stimule la motricité gastro-intestinale
Bibliographie :
- Parkman HP et coll. “Gastroparesis and functional dyspepsia: excerpts from the AGA./ ANMS meeting”. Neurogastroenterol Motil. 2010 ; 22: 113-133.
- Horowitz M et coll. ” Gastroparesis : prevalence, clinical significance and treatment” Can J Gastroenterol. 2001; 15 : 805-813.
- Stanghellini V et coll.” Risk indicators of delayed gastric emptying of solids in patients with functional dyspepsia” Gastroenterology 1996;110:1036-1042.
- Maganti K et coll. “Oral erythromycin and symptomatic relief of gastroparesis: a systematic review”. Am J Gastroenterol 2003;98:259-63.
- “Gastroparésie : quand y penser ? comment traiter ?” https://www.fmcgastro.org/postu-main/archives/postu-2011-paris/textes-postu-2011-paris/gastroparesie-quand-y-penser-comment-traiter consulté le 28 Juillet
Dernière mise à jour: Septembre 2020
La metformine est l’antidiabétique oral de première ligne le plus largement utilisé dans le traitement du diabète type2, avec des effets bénéfiques démontrés (diminution de la morbi-mortalité) (1).
Le traitement par metformine a été associé à un déficit en vitamine B12 et une augmentation de l’homocystéine et de l’acide méthylmalonique qui peuvent être neurotoxiques. Ces altérations sont expliquées par une diminution de l’absorption digestive de vitamine B12 (1).
En 1969, Berchtold et coll ont rapporté des preuves de malabsorption de la vitamine B12 chez des patients qui avaient été traités avec la metformine pendant seulement 3 mois. Dès 1971, Tomkin et coll ont recommandé que tous les patients suivant un traitement à long terme à la metformine subissent un test annuel de dépistage de la vitamine B12 sérique, sur la base d’une évaluation transversale (2).
Depuis lors, des études observationnelles transversales, rétrospectives et longitudinales, ainsi que des rapports de cas, ont suggéré une association clinique entre l’utilisation à long terme de la metformine et la carence en vitamine B12. Cependant, peu d’études prospectives contrôlées versus placebo ont été menées pour définir le risque de carence en vitamine B12 chez les personnes traitées par la metformine (2).
Les auteurs d’une étude hollandaise ont mesuré l’évolution des taux sériques de vitamine B12 associée au traitement par metformine versus placebo chez 390 diabétiques de type 2. Après un suivi moyen de 4,3 ans, une diminution du taux sérique de vitamine B12 de l’ordre de 19% a été mise en évidence, corrélée à une augmentation de l’homocystéine de 5%, qui s’accumule lors de déficit. Sur ces bases, les auteurs proposent une surveillance régulière des taux sériques lors de traitement au long cours par metformine, dans le but d’en détecter un déficit (1).
La metformine est associée à une diminution progressive du taux sérique de vitamine B12. Il faut noter que les taux sériques dans le groupe de patients traités (280 pmol/l) étaient au-dessus des seuils inférieurs de référence de valeurs normales usuelles dans la population étudiée (150 pmol/l). L’élévation de l’homocystéine chez les patients traités dans cette étude suggère effectivement un déficit en vitamine B12, mais des marqueurs plus spécifiques (acide methylmalonique, ou holotranscobalamine) n’ont pas été dosés (1).
En pratique, L’administration de metformine s’accompagne d’une diminution du taux de vitamine B12, et induisant le patient à des risques de déficit en cette vitamine suite à son utilisation prolongée, avec des conséquences potentielles telles l’anémie, la neuropathie, et la démence.
Il semble raisonnable, de considérer ce risque, avant ou au cours du traitement, surtout chez les patients âgés et partiellement dénutris. Dans le doute, un dosage est à proposer. La pertinence de mesures régulières ou d’une substitution systématique reste encore à prouver.
Bibliographie :
- A et Coll, “Faut-il doser et substituer la vitamine B12 chez les patients sous métformine? ” https://www.revmed.ch 1 page. Consulté le 28 Mai 2020.
- Vanita. R et Coll, “Long-term Metformine use and vitamine B12 deficiency in the diabets prevention program outcomes study” https://www.ncbi.nlm.nih.gov 1 page. Consulté le 28 Mai 2020.
Dernière mise à jour: juin 2020
La prescription d’un antifongique pendant la grossesse doit faire l’objet d’une prudence particulière au vue des risques de toxicité fœtale et de malformations congénitales.
Le choix du médicament et de sa voie d’administration, locale ou générale, sont des facteurs importants pour la sécurité de la grossesse et la réussite du traitement.
Traitements par voie locale :
Nitrate d’éconazole 150 mg, ovule à libération prolongée : les études chez l’animal n’ont pas mis en évidence d’effet tératogène aux doses usuelles. Les fœtotoxicités ont été observées à fortes doses. En clinique, aucune malformation ou fœtotoxicité ne sont apparues à ce jour. Toutefois, le suivi de grossesses exposées à l’éconazole est insuffisant pour exclure ce risque. L’utilisation de ce médicament ne doit pas être envisagée au cours du 1er trimestre de la grossesse sauf en cas de réelle nécessité. Il peut être utilisé aux 2ème et 3ème trimestres de la grossesse si le bénéfice pour la mère est supérieur au risque pour le fœtus (1).
Nitrate de miconazole 400 mg, capsule molle vaginale : de multiples études chez l’animal n’ont pas montré d’effet tératogène. En clinique, l’analyse d’un nombre élevé de grossesses exposées n’a pas révélé de malformations ou de fœtotoxicités causé par ce médicament. Toutefois, des études épidémiologiques permettraient de vérifier l’absence de risque. Ce médicament peut être prescrit pendant la grossesse en cas de réelle nécessité (2).
Traitements par voie générale :
Métronidazole comprimé pelliculé 500 mg : le RCP du médicament mentionne que les études chez l’animal n’ont pas mis en évidence d’effet tératogène, et qu’aucune malformation n’a été observée chez les nouveaux nés des mères prenant ce médicament. Des études épidémiologiques sont nécessaires pour permettre de vérifier l’absence de risque. En conséquence, le métronidazole peut être prescrit pendant la grossesse si besoin (3).
Fluconazole gélule de 50 mg : des données sur quelques centaines de femmes enceintes traitées par des doses standards (<200 mg/jour) de fluconazole, administrées en une seule prise ou en prises répétées pendant le premier trimestre, n’ont pas montré d’effets indésirables sur le fœtus.
De multiples anomalies congénitales ont été rapportées, incluant bradycéphalie, dysplasie auriculaire, fontanelles antérieures géantes, fémurs arqués et synostoses radio-humérales chez les enfants dont les mères ont été traitées pendant une durée égale ou supérieure à trois mois avec de fortes doses (400-800 mg par jour) de fluconazole.
Le lien de causalité entre la prise du fluconazole et l’apparition de ces effets indésirables est douteux.
Le traitement court par des doses standards de fluconazole ne doit être utilisé pendant la grossesse qu’en cas de nécessité absolue (4).
Conclusion :
Le traitement des candidoses génitales au cours de la grossesse est en règle générale local. L’application de topiques imidazolés locaux constitue le traitement de première intention. On peut avoir recours à des antifongiques par voie générale en cas de candidoses très étendues sur la région périnéale ou d’intolérance cutanée au traitement local, tout en respectant les doses standards et la courte durée du traitement.
Référence :
- ANSM « RCP- Nitrate d’éconazole ovules 150 mg» mis à jour le : 24/08/2012. Pages: 1-5.
- ANSM « RCP- Nitrate de miconazole capsule 400 mg» mis à jour le : 24/08/2012. Pages: 1-5.
- ANSM « RCP-Métronidazole Comprimé pelliculé 500 mg» mis à jour le : 09/04/2014. Pages: 1-8.
- ANSM « RCP-, Fluconazole gélule de 50 mg » mis à jour le : 15/04/2015. Pages: 1-15.
La toux est un acte réflexe, déclenché par une irritation des voies respiratoires. Elle est souvent due à une affection virale respiratoire, qui guérit spontanément en quelques jours ou semaines (1).
Les médicaments destinés à soulager la toux ont un effet uniquement symptomatique, peu ou pas supérieure à celui du placebo. Certains exposent les patients à des effets indésirables disproportionnés par rapport à l’évolution naturelle favorable des symptômes (1,2).
Des effets indésirables graves, liés aux antitussifs ont été observés à type de réactions allergiques graves (ex : l’oxomémazine, la pentoxyvérine), de troubles cardiaques (ex : la pentoxyvérine ), de dépressions respiratoires et de détresses respiratoires (ex : la pentoxyvérine ) et des douleurs abdominales (ex : la noscapine) (1,2).
Avant de prescrire un traitement antitussif, il convient de suivre les recommandations de bon usage à savoir (3) :
- Rechercher toute cause curable de la toux.
- Traiter seulement les toux gênantes.
- Prescrire le traitement pour une période courte (quelques jours) et le limiter aux horaires où survient la toux.
- Ne doit pas procéder à une augmentation des doses si la toux résiste à un antitussif administré à posologie usuelle, mais à un réexamen de la situation clinique.
- Prendre en compte la notion de l’ “effet placebo”, très importante dans le traitement de la toux.
- Ne pas prescrire les associations fixes d’antitussifs (ajustement posologique, addition des effets indésirables).
- Prescrire les antitussifs centraux (codéine, dextrométhorphane, pholcodine, noscapine) non associés, ils ont un meilleur rapport efficacité/effets indésirables.
- Rappeler aux patients d’éviter l’automédication.
En pratique, les antitussifs exposent à des effets indésirables parfois graves, alors qu’ils ne sont pas plus efficaces qu’un placebo. Ils ne doivent être donné que si la toux est très gênante et après avoir éliminés tout risque. De ce fait, il serait plus prudent de commencer par des gestes simples sans médicament à savoir, boire, sucer des confiseries, humidifier l’air, éviter les facteurs irritants, etc. Ce qui permettrait de mettre les patients à l’abri d’effets indésirables injustifiés causé par un médicament à éviter (4).
Bibliographie :
- ″Médicaments de la toux et du rhume : des effets indésirables trop graves face à des troubles bénins″ Rev Prescrire 2009 : 29 (312) : 751-753.
- ″Pour mieux soigner, des médicaments à écarter : bilan 2020″ Rev Prescrire 2019 39 (434) : 931.
- HAS ″Pholcodine″ www.has.santé.fr. Consulté le 19 avril 2020 : 05 pages.
- “Sirop dextrométhorphane + mépyramine : retour d’un médicament à écarter” RevPrescrire 2013 ; 33 (357) : 511.
L’alpha-amylase est une enzyme à visée anti inflammatoire, utilisée dans les maux de gorge (1,2).
Elle expose à des réactions d’hypersensibilité généralement cutanées mais incluent aussi des réactions anaphylactiques qui peuvent être sévères à type d’urticaire, d’angiooedème et/ou de bronchospasme ainsi qu’un choc anaphylactique (1, 2,3).
Mi 2018, la commission en charge de la réévaluation des médicaments à l’ANSM a conclu à une balance Bénéfices / Risques défavorable de l’alpha-amylase devant :
§ L’absence de preuve d’efficacité clinique (2);
§ L’analyse des 474 notifications d’effets indésirables recensées en France entre 1985 et 2017 (la moitié de ces cas concernaient des enfants). Il s’agissait le plus souvent de troubles cutanées ou allergiques : urticaire, prurit, angio-oedème, rash maculo-papuleux et érythème. Dans 98 cas, l’alpha amylase était le seul médicament suspecté, avec un délai de survenue de l’effet indésirable inférieur à 24 heures pour certains d’entre eux (2).
En pratique, l’alpha amylase est à écarter des soins, chez les patients gênés par un mal de gorge, les règles hygieno- diététiques (les confiseries à sucer et les boissons chaudes ou glacées) aident à soulager la douleur. Sinon, le paracétamol est l’antalgique de premier choix, à condition de maitriser sa posologie (2).
Néanmoins, si les médicaments contenant de l’alpha amylase devaient être utilisés, il est important de sécuriser leur emploi par des informations pour les professionnels de santé et les patients qui sont (1,3) :
Information pour les professionnels de santé :
Lors de la prescription ou de la délivrance de spécialités à base d’alpha-amylase, le professionnel de santé doit :
- Informer les patients du risque de réactions d’hypersensibilité notamment de réactions cutanées et de chocs anaphylactiques.
- Vérifier auprès des patients l’absence d’antécédents d’hypersensibilité à la substance active ou à l’un des excipients.
- Informer les patients de la nécessité d’arrêter le traitement et de consulter très rapidement un médecin en cas de signes évoquant une réaction d’hypersensibilité.
Information pour les patients :
Lors de la prise de spécialités à base d’alpha-amylase, les patients doivent:
- Arrêter immédiatement la prise de ce médicament et consulter rapidement un médecin en cas d’apparition des signes suivants : éruption cutanée telle qu’urticaire et/ou difficultés à respirer et/ou gonflement du visage et/ou chute de tension.
- Ne jamais utiliser un médicament à base d’alpha-amylase si le patient a déjà présenté une réaction allergique à l’un de ces médicaments.
- Ne pas utiliser ces médicaments au delà de 5 jours. Consulter un médecin en cas de persistance ou d’aggravation des symptômes.
Bibliographie :
- ˝Maux de gorge et médicaments à base d’alpha-amylase : l’ANSM souhaite une information renforcée sur les risques d’allergie via le conseil du pharmacien – Point d’Information˝. www.ansm.santé.fr. 01 page. Consulté le 24/12/2019.
- ˝Alpha amylase : Balance Bénéfices / Risques défavorable˝. Rev Prescrire 2019 ; 39 (426) :256.
- ˝Alpha-amylase et risque de réactions anaphylactiques – Lettre aux professionnels de santé˝. www.ansm.santé.fr. 02 pages. Consulté le 24/12/2019.
Dernière mise à jour : Mars 2020
La sécurité des patients est un problème de santé publique de part le monde. On estime qu’il y a un risque de l’ordre de 1sur trois millions de mourir en voyageant en avion, alors que le risque de décès d’un patient par accident médical évitable est estimé à 1 sur 300.
Les principaux risques de sécurité du patient lors des soins sont nombreux, l’OMS les a résumé en 10 faits qui sont les suivants :
Fait n ° 1: un patient sur 10 est blessé pendant qu’il reçoit des soins hospitaliers
Les estimations montrent que dans les pays à revenu élevé, jusqu’à un patient sur dix subit des dommages lorsqu’il reçoit des soins hospitaliers. Le préjudice peut être causé par une série d’événements indésirables, et dans 50% elles sont considérées comme évitables.
Une étude sur la fréquence et l’évitabilité des événements indésirables a montré que dans 26 hôpitaux de huit pays à revenu faible ou intermédiaire, le taux d’événements indésirables était d’environ 8%. Parmi ces événements, 83% étaient évitables, et 30% étaient associés au décès du patient.
Fait 2: La survenue d’effets indésirables dus à des soins non sécurisés est probablement l’une des 10 principales causes de décès et d’invalidité dans le monde : La survenue d’événements indésirables, résultant de soins non sécurisés, est probablement une des 10 principales causes de décès et d’invalidité dans le monde. Des preuves récentes suggèrent que 134 millions d’événements se produisent chaque année en raison de soins non sécurisés dans les hôpitaux de pays à revenu faible ou intermédiaire, entraînant 2,6 millions de décès par an.
Une autre étude a estimé qu’environ deux tiers des événements indésirables résultent de comportements à risque, avec des invalidités et des décès (appelées années de vie corrigées d’invalidité).
Fait 3: Quatre patients sur dix subissent des dommages en santé primaire et ambulatoire :
Un patient sur quatre est blessé lorsqu’il reçoit des soins de santé et jusqu’à 80% des dommages sont considérés comme évitables. Les erreurs les plus préjudiciables sont liées au diagnostic, à la prescription et à l’utilisation de médicaments.
Fait 4: Au moins un dollar canadien sur sept est dépensé pour traiter les effets indésirables du patient dans les soins hospitaliers :
1 dollar canadien sur 7 est dépensé pour traiter les effets du préjudice causé aux patients lors des soins hospitaliers. 15% des dépenses et des activités hospitalières dans les Pays de l’Organisation de coopération et de développement économiques (OCDE) sont dépensés dans des effets indésirables, les plus lourds étant les caillots sanguins (thromboembolie veineuse, escarres)
On estime que le coût total des dommages dans ces pays représente à lui seul des milliards de dollars américains tous les ans.
Fait 5: Un investissement dans la sécurité des patients peut générer d’importantes économies financières : Une plus grande implication du patient est la clé de la sécurité des soins. Faire participer les patients n’est pas cher et représente une valeur sure.
Fait 6: Des pratiques médicamenteuses non sécurisés et des erreurs de médication nuisent à des millions de patients et coûte des milliards de dollars chaque année : des dosages incorrects, une mauvaise instruction, l’utilisation d’abréviations et de prescriptions inappropriées, sont une cause majeure de préjudices évitables dans les soins de santé dans le monde.
Les erreurs ont été estimées à 42 milliards de dollars par an, sans compter les pertes de salaire, de productivité ou coûts des soins de santé. Cela représente près de 1% des dépenses mondiales en santé.
Des erreurs causées par des facteurs humains tels que fatigue, mauvaises conditions de travail ou pénurie de personnel affectent la prescription, le stockage, la préparation, les pratiques de distribution, d’administration et de surveillance.
Fait 7: Un diagnostic inexact ou retardé est l’une des causes les plus courantes de patient nuit et affecte des millions de patients : L’erreur diagnostique se voie chez environ 5% des adultes dans les établissements de soins ambulatoires des États-Unis. La moitié de ces erreurs peut causer des dommages graves.
Fait 8: Les infections hospitalières touchent jusqu’à 10 patients hospitalisés : Chaque année dans le monde, des centaines de millions de patients sont touchés par les infections hospitalières, 7% dans les pays à revenu élevé et 10% pour les pays à revenu faible.
Fait 9: Plus d’un million de patients meurent chaque année de complications liées à la chirurgie : Les procédures chirurgicales non sécuritaires entraînent des complications chez 25% des patients.
7 millions de patients présentant une complication dans l’année, et 1 million meurent au cours ou immédiatement après la chirurgie.
En raison de l’amélioration des mesures sécuritaire des patients, les décès liés aux complications de la chirurgie ont diminué au cours des 50 dernières années. Néanmoins, ils restent deux à trois fois plus élevés dans les pays à revenu faible et intermédiaire par rapport aux pays à revenu élevé.
Fait 10: L’exposition médicale aux rayonnements est un problème de santé publique et de sécurité des patients : Plus de 3,6 milliards d’examens par rayons X sont pratiqués chaque année dans le monde. Les erreurs de rayonnement impliquent une surexposition aux rayonnements. Une évaluation de 30 années de données publiées sur la sécurité en radiothérapie estime que l’incidence globale des erreurs est d’environ 15 pour 10 000 traitements.
L’accès sans la qualité ne serait qu’une promesse vide dans l’optique de la couverture des soins de santé. La qualité n’est pas une prérogative des pays à haut revenu. Dès lors qu’un pays est en mesure de fournir des soins de santé et même les pays les plus pauvres peuvent et doivent le faire, il doit fournir des soins de bonne qualité ; ne pas le faire serait non seulement préjudiciable pour les patients mais conduirait aussi au gaspillage de précieuses ressources qui pourraient être investies au profit d’autres secteurs clés pour le développement économique et social.
Réference : https://www.who.int/campaigns/world-patient-safety-day/2019
Dernière mise à jour : Octobre 2019
L’odeur corporelle d’une même personne peut varier en fonction de différents facteurs, notamment l’état émotionnel, l’âge, l’alimentation, le cycle menstruel, certaines maladies, la prise de médicaments (1) etc.
La mauvaise odeur corporelle peut être aggravée si la personne a tendance à trop transpirer (1). On appelle cela l’hyperhidrose (1). En générale, elle n’est liée à aucun problème de santé particulier (1).
La sueur est une substance corporelle synthétisée à partir du sang par de petites glandes enfouies sous la peau (1). Elle est ensuite évacuée à la surface par de petits canaux et son évaporation permet de stabiliser la température interne du corps (1). La sueur est pratiquement inodore mais les bactéries présentes sur la peau se multiplient rapidement en présence de sueur, et la décomposition consécutive de la sueur en acides pouvant causer l’odeur (1) (27).
Quels sont les types de médicaments pouvant causer la transpiration et les odeurs corporelles?
Certains médicaments ont un lien avec l’odeur corporelle et la transpiration (2):
- carnitine : Après absorption, la carnitine est normalement transformée au niveau hépatique en triméthylamine (TMA) (3). Cette dernière subit a son tour une métabolisation enzymatique hépatique et est oxydée en triméthylamine N-oxyde (TMAO) qui est éliminée par diverses voies de l’organisme (urines, salive, sueur. . .) (3). Or, la TMA est un composé malodorant dont l’odeur rappelle celle du poisson pourri alors que le TMAO est inodore (3). Un déficit enzymatique du métabolisme de l.carnitine conduit à un excès de TMA dans l’organisme qui sera directement éliminé sans être oxydé en TMAO (3). Les patients porteurs de ce déficit excrètent par conséquent par tous les fluides de l’organisme (salive, urines, transpiration, sécrétions génitales. . .) le TMA qui leur donne une mauvaise odeur (3). Un autre mécanisme peut également être suggéré une voie d’élimination du TMAO saturable au-delà d’une dose seuil, avec dans ces cas une production en TMA plus importante nécessitant d’être excrétée directement et responsable de l’apparition de cette mauvaise odeur (3).
- Les esters éthyliques d’acides oméga-3 : parmi les effets indésirables observé est l’odeurs corporelles qui est le résultat de la toxicité de l’éthanol libéré de forme d’ester éthylique d’huile de poisson très concentré (l’oméga 3 est un des composition de l’huile de poisson ) (2) (21) (26).
- L’acétate de leuprolide (2).
- Le topiramate : odeur cutanée anormale (2) (5).
- La cystéamine : odeur de peau anormale (4)
- La phénylbutyrate de sodium : odeur anormale de la peau (6)
- Le chlorhydrate de sertraline : hyperhidrose, sueurs froides, odeur cutanée anormale (2) (15).
- Le bexarotene: sueurs, changement des odeurs corporelles (19) (22).
- La phénylbutyrate de glycérol : Odeur anormale de la peau, hyperhidrose (24).
Quelques médicaments peuvant induire une transpiration susceptible de causer une odeur corporelle :
- Des antidépresseurs :
- Chlorhydrate de bupropion : sueurs (2) (8).
- Chlorhydrate de clomipramine : sueur (2) (9).
- Chlorhydrate de duloxétine : hypersudation, sueurs nocturnes, sueurs froides (2) (10).
- Oxalate d’escitalopram : hypersudation (2) (11).
- Chlorhydrate de fluoxétine : hyperhidrose, sueurs froides (2) (12).
- Chlorhydrate de paroxétine : hypersudation (2) (13).
- Mésilate de paroxétine : hypersudation (2) (14).
- Chlorhydrate de venlafaxine : hyperhidrose (incluant sueurs nocturnes) (2) (7) (16).
- Tamoxifène (7).
- Interféronalfa-2a : sueurs (17) (18).
- Prégabaline: hyperhidrose (19) (20).
- Gabapentine : sueurs causée par le syndrome de sevrage (19) (23).
- Zidovudine: sueurs (19) (25).
Bien que peu fréquents, certains individus subissent une augmentation de la transpiration causée par :
- Les anti-inflammatoires non stéroïdiens (AINS) : ces effets indésirables ont été rapportés avec le kétoprofène et le naproxène (2) (17).
- Pilocarpine (7) (19).
Au total
En général, il peut être difficile de prédire si un médicament donné va générer une odeur corporelle chez un individu donné, car le métabolisme des médicaments diffère en fonction de la génétique et de l’état de santé de l’individu. Bien que, de nombreux médicaments provoquent une transpiration qui peut entraîner une odeur corporelle seuls quelques groupes de médicaments sont connus pour produire ces effets indésirables (2). Penser à informer le patient.
Bibliographie :
- “Le point sur les odeurs corporelles” https://www.passeportsante.net/fr/Actualites/Dossiers/DossierComplexe.aspx?doc=odeurs-corporelles P : 6 [consulté le 12/04/2019].
- “What medicines cause body odor?” https://health.howstuffworks.com/wellness/men/sweating-odor/medicines-cause-body-odor.htm P : 6 [consulté le 12/04/2019].
- Rocher F et al ʺtraitement par L-carnitine et mauvaise odeur corporelle : un effet secondaire a connaitreʺ Rev neurologie. 2011, 167(6-7) : 541-544
- “Cystéamine” https://www.ema.europa.eu/en/documents/product-information/cystagon-epar-product-information_fr.pdf P : 34 [Consulté le 16/04/2019]
- “Topiramate” http://base-donnees-publique.medicaments.gouv.fr/affichageDoc.php?specid=67971025&typedoc=R P : 12 [Consulté le 16/04/2019]
- “Phénylbutyrate de sodium” https://www.ema.europa.eu/en/documents/product-information/ammonaps-epar-product-information_fr.pdf P : 34 [Consulté le 16/04/2019]
- ʺEst odeur corporelle un signe de maladie? ʺ https://www.eukaflex.com/2VLZEBw0/ P : 1 [Consulté le 16/04/2019]
- “Chlorhydrate de bupropion” http://agence-prd.ansm.sante.fr/php/ecodex/frames.php?specid=64556383&typedoc=R&ref=R0214809.htm P : 9 [Consulté le 21/04/2019]
- “Chlorhydrate de clomipramine” http://agence-prd.ansm.sante.fr/php/ecodex/rcp/R0205291.htm P : 9 [Consulté le 16/04/2019]
- “Chlorhydrate de duloxétine” http://agence-prd.ansm.sante.fr/php/ecodex/rcp/R0316867.htm P : 15 [Consulté le 16/04/2019]
- “Oxalate d’escitalopram” http://agence-prd.ansm.sante.fr/php/ecodex/rcp/R0234324.htm P : 12 [Consulté le 16/04/2019]
- “Chlorhydrate de fluoxétine” http://agence-prd.ansm.sante.fr/php/ecodex/rcp/R0278605.htm P : 15 [Consulté le 16/04/2019]
- “Chlorhydrate de paroxétine hémihydraté ” http://agence-prd.ansm.sante.fr/php/ecodex/rcp/R0237104.htm P : 14 [Consulté le 16/04/2019]
- “Mésilate de paroxétine” http://agence-prd.ansm.sante.fr/php/ecodex/rcp/R0218405.htm P : 13 [Consulté le 16/04/2019]
- “Chlorhydrate de sertraline” http://agence-prd.ansm.sante.fr/php/ecodex/rcp/R0224134.htm P : 16 [Consulté le 16/04/2019]
- “Chlorhydrate de venlafaxine” http://agence-prd.ansm.sante.fr/php/ecodex/rcp/R0232099.htm P : 14 [Consulté le 16/04/2019]
- Thérapeutique dermatologique ” troubles de la sudation : hyperhidrose et hypohidrose” http://www.therapeutique-dermatologique.org/spip.php?article1155 P : 6 [Consulté le 17/04/2019]
- “Interféron alfa-2a” http://agence-prd.ansm.sante.fr/php/ecodex/rcp/R0074715.htm P : 10 [Consulté le 21/04/2019]
- Sider : body odor http://sideeffects.embl.de/se/C0085595/ P : 1 [Consulté le 24/04/2019]
- “Prégabaline.” http://agence-prd.ansm.sante.fr/php/ecodex/rcp/R0263927.htm P : 10 [Consulté le 24/04/2019]
- “omega-3-acid ethyl esters” https://www.accessdata.fda.gov/drugsatfda_docs/label/2009/021654s023lbl.pdf P : 12 [Consulté le 24/04/2019]
- “Bexarotène.” https://www.ema.europa.eu/en/documents/product-information/targretin-epar-product-information_fr.pdf P : 29 [Consulté le 24/04/2019] http://agence-prd.ansm.sante.fr/php/ecodex/rcp/R0232717.htm P : 6 [Consulté le 29/04/2019]
- Annexe I “résumé des caractéristiques du produit ” http://bijsluiters.fagg-afmps.be/registrationSearchServlet?key=EU/1/15/1062/001&leafletType=rcp P : 19 [Consulté le 29/04/2019]
- “lamivudine /zidovudine” , effets indesirables : “zidovudineʺ http://agence-prd.ansm.sante.fr/php/ecodex/rcp/R0217368.htm P : 12 [Consulté le 29/04/2019]
- L’huile de poisson Triglycérides contre Esters éthyliques ʺEffets secondaires: l’ester éthylique par rapport triglycéride : forme ester éthyliqueʺ https://shorthillseye.com/fish-oil-triglycerides-vs-ethyl-esters/ P: 5 [Consulté le 06/05/2019]
- ʺLes Maladies ont-elles une Odeur? ʺ https://french.mercola.com/sites/articles/archive/2018/03/18/les-maladies-influent-sur-l%E2%80%99odeur-corporelle.aspx P: 6 [consulté le 26/05/2019]
Le trastuzumab, un anticorps monoclonal utilisé dans le cancer du sein précoce ou métastatique ou dans le cancer gastrique métastatique, présentant une surexpression et une amplification du gène HER2.
Le trastuzumab a amélioré le pronostic vital de nombreux patients. Cette amélioration exige une surveillance des effets indésirables psychiatriques, oculaires, hématologiques et notamment cardiaques, à plus long terme. L’identification des éléments liés à une cardiotoxicité est importante pour optimiser le rapport bénéfices/risques du trastuzumab.
Le dysfonctionnement cardiaque est un effet indésirable grave et fréquent lié à l’utilisation du trastuzumab (cardiotoxique). La forme clinique se manifeste le plus souvent par une diminution asymptomatique de la fraction d’éjection ventriculaire gauche (FEVG).
Des mesures de surveillance cardiaque pendant le traitement pour réduire la fréquence et la sévérité du dysfonctionnement cardiaque sont nécessaires à savoir :
- L’évaluation de la fonction cardiaque devrait être réalisée à l’initiation du traitement et répétée tous les 3 mois pendant la durée du traitement du trastuzumab. Elle doit être poursuivie tous les 6 mois après l’arrêt du médicament, jusqu’à 24 mois après la dernière administration de ce dernier.
- La mesure de la fraction d’éjection ventriculaire gauche (FEVG) par un échocardiogramme ou une scintigraphie cardiaque est la méthode requise pour surveiller la fonction cardiaque.
- La diminution du pourcentage de la FEVG ≥ 10 points par rapport à sa valeur initiale s’il est inférieur à 50 %, nécessite l’arrêt du traitement et une nouvelle évaluation de la FEVG dans un délai d’environ 3 semaines.
- L’information des prescripteurs de poursuivre une surveillance cardiaque régulière pour réduire la fréquence et la sévérité des dysfonctionnements ventriculaires gauches et des insuffisances cardiaques congestives.
En pratique, le suivi cardiologique régulier des patients sous trastuzumab est capital afin d’améliorer la prise en charge des patients en oncologie.
Bibliographie :
- ʺRappel de l’importance des mesures de surveillance cardiaque pendant le traitement pour réduire la fréquence et la sévérité des dysfonctionnements ventriculaires gauches et des insuffisances cardiaques congestivesʺ. www.ansm.santé.fr . Consulté le 22/01/2019.
- ʺSuivi cardiologique d’un patient oncologiqueʺ. Rev Med Suisse 2010. 6 (251):1133-1139.
Dernière mise à jour : Mars 2019
La vision des couleurs est trichromatique*, la perception s’effectuant grâce à un système récepteur, un système de transmission et un système d’intégration corticale.
Cette perception peut être altérée par un dysfonctionnement dont l’origine est soit:
- Génétique, entraînant l’apparition de dyschromatopsies héréditaires (1) ;
- liés à une maladie ophtalmologique : inflammation intraoculaire (uvéite), inflammation du nerf optique, etc.,
- Causé par une maladie générale : le diabète, la sclérose en plaques, le SIDA, etc.,
- Induits par des médicaments (8).
Rôle des médicaments dans les troubles de la vision des couleurs :
Les médicaments à l’origine de troubles de la vision des couleurs appartiennent a des classes pharmacologiques variés. Ils sont surtout à l’ origine de neuropathies, de rétinopathies ou de modifications du signales transmis. Les mécanismes ne sont pas toujours connus ou décrits. (2)
Tableau 1 : médicaments qui induisent des troubles de la vision des couleurs. (2, 3, 4, 5, 6, 9, 10, 11,12).
| Médicaments | Type d’atteinte | Réversibilité |
|---|---|---|
| nhibiteurs de la phosphodiestérase de type 5 (Médicament des troubles de l’érection) Sildénafil Tadalafil Vardénafil. (2 ; 6) | Sidénafil : les nuances de couleurs apparaissent le plus souvent bleues ou bleues-vertes, parfois roses ou jaunes, des couleurs foncées semblent plus sombres et la distinction des couleurs est difficile. Ces effets sur la rétine sont dose-dépendants et imputés à l’effet inhibiteur de la phosphodiestérase du sildénafil. | Bénin et réversible |
| Tadalafil : troubles de la vision des couleurs dont des cyanopsies*. | Bénin et réversible | |
| Vardénafil : des troubles de la vision des couleurs. | Bénin et réversible | |
| Digitaliques Digoxine (2 ; 3) | Médicament à marge thérapeutique étroite. Les troubles de la vision des couleurs sont un signe d’alerte d’une surdose en digoxine, avec prédominance du jaune, plus rarement de vert, rouge, marron, bleu ou blanc (2). | Non documenté |
| Anti-fibrinolytique L’acide tranéxamique. (2) | Induit parfois des rétinopathies associées à des troubles visuels, dont des troubles de la vision des couleurs. | Souvent réversibles en quelques jours après l’arrêt du médicament |
| Diurétiques : l’hydrochlorothiazide et le furosémide. (2) | Des visions jaunes. | Non documenté |
| Interférons antiviraux Interféron alfa. (2) | Atteintes rétiniennes le plus souvent sans altération de l’acuité visuelle. Mais des diminutions sévères et irréversibles de l’acuité visuelle ont été rapportées, ainsi que des atteintes du champ visuel. Des troubles de la vision des couleurs ont été rapportés. | Non documenté |
| Antituberculeux Ethambutol. (2) | Neuropathies optiques qui se manifestent par divers troubles visuels dont des diminutions de l’acuité visuelle, des altérations du champ visuel, des défauts de perception du rouge/vert. | Le plus souvent réversibles en quelques semaines ou quelques mois, parfois plus, voire irréversibles |
| Quinolones Acide nalidixique et fluméquine. (2) | Des cyanopsies* transitoires ont été rapportées. | Non documenté |
| Antibactériens des oxazolidinones Linézolide. (2 ; 4) | Neuropathies optiques, les troubles de la vision des couleurs sont des signes d’alerte. | Non documenté |
| Nitro-5-imidazolés Métronidazole. (2 ; 5) | Neuropathies optiques, se manifestant notamment par des troubles de la vision des couleurs, des baisses de l’acuité visuelle, des scotomes. | Un déficit résiduel persiste parfois après arrêt du médicament |
| Antifongiques imidazolés Voriconazole. (2) | Des troubles de la vision des couleurs sont parfois observés. | Non documenté |
| Antipaludiques Chloroquine Hydroxychloroquine Quinine (2 ; 10) | Chloroquine : rétinopathies à l’origine de visions floues, de difficultés d’accommodation, de troubles de la vision des couleurs, de pertes parfois sévères de l’acuité visuelle. | A l’arrêt du médicament, ces troubles sont susceptibles de persister, voire de s’aggraver. |
| Hydroxychloroquine : rétinopathies, à l’origine de troubles de la vision des couleurs | Non documenté | |
| Quinine : une toxicité oculaire lors de surdoses, les symptômes sont vision floue, troubles de la vision des couleurs, altération du champ visuel, cécité. Les mécanismes évoqués sont une action sur la vascularisation de la rétine ou une toxicité directe sur la rétine. | Des déficites résiduels persistent parfois après arrêt du médicament. | |
| Chélateur du fer Déferoxamine (2) | Troubles visuels, surtout lors de traitements au long cours et à fortes doses : neuropathies optiques, troubles de la vision des couleurs, ect. | le plus souvent réversibles à l’arrêt de la déferoxamine |
| Hypoglycémiant Rosiglitazone. (2) | Œdèmes maculaires se manifestant notamment par une diminution de la sensibilité aux couleurs et une difficulté d’adaptation à l’obscurité. | L’arrêt du traitement permet une amélioration ou une guérison |
| Anti-inflammatoires non stéroïdiens (AINS) l’indométacine et ses dérivés. (2) | Neuropathies optiques avec troubles de la vision des couleurs. | Non documenté |
| Antiépileptique Carbamazépine. (2 ; 5) | Des troubles de la vision des couleurs ont été rapportés. Ils semblent liés à une atteinte rétinienne. | Non documenté |
| Antipsychotiques phenothiaziniques Thioridazine. (2 ; 3) | Des troubles de la vision des couleurs ont été rapportés, notamment une coloration marron de la vision. | À l’arrêt de la thioridazine, les lésions sont susceptibles de s’aggraver. |
| Les inhibiteurs de la monoamine oxydase (2) | Lésions oculaires graves irréversibles annoncées par des troubles de la vision des couleurs. | Non documenté |
| Isotrétinoïne (2) | Des atteintes oculaires notamment de rares troubles de la vision des couleurs. | réversibles à l’arrêt de l’isotrétinoïne |
| Antihistaminique H1 Diménhydrinate (2) | Discrimination des couleurs. | Non documenté |
| Barbituriques (9) | Xanthopsie* par intoxication par les barbituriques. | Non documenté |
| Anti-arythmique Amiodarone (5 ; 11) | Dyschromatopsie rouge/vert. | Non documenté |
| Disulfirame (2) | Neuropathies périphériques, neuropathies optiques et atrophies optiques. Des troubles de la vision des couleurs ont été rapportés. | Non documenté |
| Psychotropes : Neuroleptiques, antidépresseurs tricycliques, inhibiteurs de la recapture de la sérotonine, benzodiazépines (10) | Les atteintes sont fréquentes et diverses : mouvements oculaires anormaux, altération de la vision des couleurs ou des contrastes ect ., par effet toxique. | Non documenté |
| Anti-estrogène Tamoxifen (12 ; 5) | Déficit des couleurs bleu/jaune par opacité cornéenne et cataracte qui peuvent causer une vision jaunâtre. | Non documenté |
NB!
L’association de plusieurs médicaments ayant cet effet majore le risque. (6)
En pratique
Devant l’apparition de troubles de la vision des couleurs, penser au médicament.De ce fait il est important d’informer les patients qui prennent des médicaments susceptibles de causer des troubles de la vision des couleurs. (6)
Glossaire
Le trichromatisme*:
Le trichromatisme (la vision des couleurs normale) provient de 3 lumières monochromatiques : le rouge, le vert et le bleu, appelées ‘couleurs fondamentales’, qui une fois additionnées dans des proportions convenables permettent d’obtenir toutes les couleurs. (1)
Cyanopsies* :
La cyanopsie est une affection de la vision dans laquelle tout est plus ou moins vu en bleu. (15)
Xanthopsie* :
La xanthopsie est un trouble visuel assez rare, de la vision des couleurs.
Cette pathologie entraîne une vision jaunâtre de tous les objets environnants. (14)
Bibliographie
- http://orthoptie.net/ToposFB/rabcld.pdf
- ‘troubles de la vision des couleurs d’origine médicamenteuse’ revue prescrire février 2012 ; 32(340) :113-116
- https://pharmacomedicale.org/medicaments/par-specialites
- https://www.vidal.fr/substances/21801/linezolide/
- http://www.doctissimo.fr/html/medicaments/medicaments.htm
- Interaction médicamenteuses « troubles de la vision des couleurs médicamenteux en bref» application prescrire juin 2018 :276
- https://www.maxicours.com/se/fiche/0/1/368610.html/1s
- http://www.e-sante.fr/vision-couleurs/guide/1633
- https://ophtalmologie.pro/troubles-vision-couleurs/
- https://www.revmed.ch/RMS/2015/RMS-N-499/Toxicite-medicamenteuse-et-ophtalmologie
- https://www.livestrong.com/article/206044-medications-that-affect-color-vision/
- https://www.researchgate.net/publication/310651102_Drug-Induced_Deficits_in_Color_Perception_Implications_for_Vision_Rehabilitation_Professionals
- http://eyecare2020.com/blog/2014/05/7-interesting-facts-about-the-color-of-our-eyes/
- https://www.vulgaris-medical.com/encyclopedie-medicale/xanthopsie
- https://www.vulgaris-medical.com/encyclopedie-medicale/cyanopsie
Dernière mise à jour : Septembre 2018
- Le priapisme est défini comme la survenue d’une érection anormalement prolongée (> 4 heures) souvent douloureuse et irréductible, en dehors de toute stimulation sexuelle. (1)
- Le mécanisme érectile est semblable à un système hydraulique avec une entrée (l’artère caverneuse), une partie gonflable (les aréoles caverneuses) et enfin la voie de sortie (veine dorsale de la verge) qui laisse ou non sortir le contenu sanguin des aréoles) (1)
- Le priapisme est lié à des anomalies de l’hémodynamique du sang intra caverneux et du blocage de la recontraction du muscle lisse érectile caverneux entrainant l’absence du drainage veineux des corps caverneux qui ne s’évacuent pas correctement par la veine dorsale profonde (1).
- On distingue deux types de priapisme :
- les priapismes à haut débit, expliqués par une augmentation du flux artériel, Ils sont souvent liés à un traumatisme du pénis. leur traitement peut être différé. (2)
- les priapismes à bas débit, dus à une anomalie du retour veineux, qui est très douloureux et constitue une véritable urgence
- Le traitement du priapisme est essentiellement médical, mais il est nécessaire d’avoir recours à la chirurgie si échec.
- Le risque d’impuissance séquellaire par fibrose des corps caverneux est fonction du délai écoulé entre le début du priapisme et la mise en route du traitement (1)
- Les principales causes du priapisme à bas débit sont : (2)
- Les hémopathies (maladies du sang) dont l’anémie falciforme, certaines leucémies et les troubles de la coagulation sanguine ;
- la consommation de cocaïne et de marijuana.
- La prise de certains médicaments, qui sont détaillés dans le tableau suivant:
| Classes thérapeutiques | Mécanisme de survenu | Médicaments |
|---|---|---|
| Les Neuroleptiques (3) | Blocage des récepteurs α-adrénergiques=> blocage de la recontraction du muscle lisse caverneux et donc de la détumescence (Mécanisme neuromusculaire) | Neuroleptiques typiques : chlorpromazine, fluphénazine, halopéridol, phénothiazine |
| Neuroleptiques atypiques : clozapine, rispéridone, olanzapine, quétiapine |
||
| Les antidépresseurs (3) | Rétrécissement anormal des veines du pénis, de sorte que le sang supplémentaire qui pénètre dans le pénis pour produire une érection ne peut pas sortir normalement et l’organe reste debout. | trazodone, néfazodone, fluoxétine, sertraline |
| Anxiolytiques (3) | Mécanisme non documenté | Buspirone, hydroxyzine |
| Anticoagulants (3) | – Mécanisme immuno-allergique | héparines, acenocumorol, la warfarine |
| Antihypertenseurs (3) | Antagonistes des récepteurs alpha-adrénergiques | Térazosine, Tamsulosine, Alfuzosine, prazosine. |
| Inhibiteurs de la phosphodiéstérase de type 5 (PDE5) (4) | Déséquilibre des mécanismes de régulation du cycle relaxation-contraction du muscle lisse. | Tadalafil, sildénafil |
| Injections intra-caverneuses de drogues vaso-actifs (5), (4) | ces drogues peuvent induire une réponse exagérée et prolongée de l’érection masculine qui peut avoir de graves conséquences (5) | Papavérine ++, PGE1 (4) |
En pratique, Le traitement du priapisme dépendra de la cause et du délai de consultation. Il est nécessaire de faire un bilan en urgence pour rechercher la cause, sauf si celle-ci est évidente. En plus du traitement causal, d’autres moyens simples peuvent aider à la régression voire la résolution du priapisme : injection d’un médicament, l’étiléphril, dans les corps caverneux ou ponction si le priapisme a plus de 3 heures. Exceptionnellement, il est nécessaire d’avoir recours à la chirurgie en cas d’échec des traitements médicaux.
Le meilleur traitement reste la prévention, notamment en prenant conscience des risques de priapisme, secondaire à la prise de certains médicaments (cités plus haut). De la même manière, les patients ayant des maladies chroniques pouvant entraîner un priapisme comme la drépanocytose, doivent être informés de ce risque et de la nécessité de consulter en urgence.
En Résumé:
Le priapisme est une pathologie multifactorielle. En plus des hémopathies telles que les anémies falciformes, les leucémies et les troubles de la coagulation, de la consommation de certaines drogues, les médicaments peuvent être à l’origine du priapisme tels que les neuroleptiques, les anxiolytiques, les anticoagulants, les antihypertenseurs, les inhibiteurs de la phosphodiesterase de type 5 et les injections intra caverneuses de drogues vaso- actives.
Bibliographie
- http://urgences-serveur.fr/IMG/article_PDF/Priapisme_a1198.pdf 01/08/2018, 13 :00
- https://undermypen.wordpress.com//?s=priapisme&search=Go 01/08/2018, 13 :30
- latunisiemedicale.com/telecharger-pdf.php?…/TUNISMED-2… 02/08/2018, 11 :32
- https://www.urofrance.org/nc/science-et-recherche/base-bibliographique/article/html/priapismes.html, 02/08/2018, 13 :50
- https://www.info-senior.com/substances-vasodilatatrices-et-priapisme.html 02/08/2018, 11 :50
Dernière mise à jour : Septembre 2018
La couleur et la texture des cheveux sont génétiquement déterminées (1,2). Diverses modifications ont été inventoriées, avec des causes non médicamenteuses ou médicamenteuses : hyperpigmentation, dépigmentation, nouvelle coloration, cheveux raides, cheveux crépus ou laineux.
Les principales causes non médicamenteuses sont une hypomélanose, albinisme, dysthyroïdie, vitiligo, l’insuffisance surrénalienne et l’exposition professionnelle à divers toxiques : arsenic, cobalt, plomb, mercure, etc.
De nombreux médicaments, très variés peuvent être en cause, le mécanisme de survenue des modifications n’est pas encore élucidé.
Les médicaments les plus souvent incriminés dans la modification de la couleur de cheveux sont
| Modification de la couleur | Classes pharmacologiques | Médicaments en cause | |
|---|---|---|---|
| Des cheveux foncés | Des antiparkinsoniens | – Carbidopa, lévodopa (6). | |
| Des anticancéreux | – Mitoxantrone (9) ; – Tamoxifène (10) |
||
| Un anti arythmique | – Vérapamil (11). | ||
| Un protecteur contre les rayons UV a usage systémique. | – Acide para-amino-benzoïque (5). | ||
| Des cheveux clairs | Un antiépileptique | – Acide valproique (12). | |
| Un antipaludéen | – Chloroquine (13). | ||
| Un myorelaxant | – Méphénésine (15). | ||
| Un immunomodulant | – Interféron alpha (14). | ||
| Un effet variable sur la pigmentation (hyperpigmentation ou dépigmentation) | Des inhibiteurs de protéine kinase | – Imatinib (18,19) ; – Sugen(18,19). |
|
| Une nouvelle couleur | Couleur jaune | Un antipsoriasique topique | – Dithranol (20). |
| Couleur rouge | Un corticoïde | – Clioquinol (21). | |
| Antibiotiques cytotoxiques | – Doxorubicine (22) ; – Bléomycine (23). |
||
| Couleur verte | Un anesthésique général | – Propofol (26). | |
| Un antifongique local | – Sulfure de Sélinium (27). | ||
Cependant, la modification de la texture de cheveux pouvant être provoquée par la prise de certains médicaments à savoir : (3).
| Modification de la texture | Classes pharmacologiques | Médicaments en cause |
|---|---|---|
| Des cheveux raides | Un immunomodulant | – Interféron (28). |
| Des cheveux crépus ou laineux | Des inhibiteurs de la protéase du HIV | – Lamivudine, stavudine (30) |
| Un rétinoïde | – Isotrétinoine (31). |
D’autres médicaments peuvent donner plusieurs aspects en même temps notamment :
| Aspect des cheveux | Classes pharmacologiques | Médicaments en cause |
|---|---|---|
| Cheveux clairs, crépus ou laineux. | Un antiépileptique | – Acide valproique (12, 32). |
| Cheveux foncés, rouges, crépus ou laineux. | Un rétinoide | – Etrétinate (8, 25). |
| Cheveux foncés, crépus ou laineux. | Un immunosuppresseur | – Ciclosporine (7,29). |
| Effet variable sur la couleur et la texture (clairs, foncés, raides crépus ou laineux). | Un antinéoplasique | – Cisplatine (4,17). |
| Cheveux clairs ou rouges. | Autres | – Minoxidil (16, 24). |
En pratique, la recherche d’une cause médicamenteuse fait partie intégrante de l’interrogatoire devant une modification de la couleur et de la texture des cheveux. Cette recherche apporte parfois la clé d’une situation gênante.
Bibliographie
- Enjolars O “cuir chevelu et pathologie pilaire”.In : Godeau P et coll . “Traité de médecine“ 3 ème éd, Flammarion Médecine-Sciences, Paris 1996 : 823825 .
- Dawber RPR “Hair colour” . In : Camocho E et Montagna W “Trichologie” Aula Medica, Madrid 1997 : 169-177 .
- “Modification de la couleur ou de la texture de cheveux’’Rev Prescrire 2004. 24 (249): 275
- Bublin JG et Thompson DF “Drug-induced hair colour changes” J Clin Pharm Ther1992 ; 17 : 297-302
- Reynolds NJ et coll . “Darkening of white hair in Parkinson’s disease” Clin Exp Dermatol1989 ; 14 : 317-318.
- Rebora A et coll . “Cyclosporin A-induced hair darkening” Int J Dermatol1999 ; 38(3) : 229-230
- Vesper JL et Fenske NA “Hair darkening and new growth associated with etretinate therapy” J Am Acad Dermatol1995 ; 34 : 860 .
- Prescrire Rédaction “Cancéreux, ne vous faites plus de cheveux blancs !” Rev Prescrire1985 ; 5(47) : 41
- Hampson JP et coll . “Tamoxifen-induced hair colour change” Br J Dermatol 1996 ; 132 : 483-484 .
- Read GM “Verapamil and hair colour change” Lancet1991 ; 338 : 1520
- Herranz JL et coll . “Change in hair colour induced by valproic acid“ Dev Med Child Neurol 1981 ; 23 : 386-387 .
- Asch PH et coll . “Achromotrichie due à la chloroquine : étude ultrastructurale“ Ann Dermatol Venereol 1997 ; 124 : 552-556 .
- Fleming CJ et MacKie RM “Alpha interferoninduced hair discolouration“ Br J Dermatol1996 ; 135 : 337-338 .
- Spillane JD “Brunette to Blonde . Depigmentation of human hair during oral treatment with mephenesin” BMJ1963 ; : 997-1000 .
- Traub YM et coll . “Treatment of severe hypertension with minoxidil“ Isr J Med Sci 1975 ; 11 : 991-998 .
- Robinson A et Jones W “Changes in scalp hair after cancer chemotherapy“ Eur J Cancer Clin Oncol 1989 ; 25 (1) : 155-156 .
- Etienne G et coll .“Imatinib mesylate and gray hair” N Engl J Med 2002 ; 347(6) : 446 .
- Robert C et coll . “Tyrosine kinase inhibition and grey hair” Lancet2003 ; 361 : 1056 .
- Rogers MJ et coll . “Yellow hair discoloration due to anthralin“ J Am Acad Dermatol1988 ; 19(2 part1) : 370-371 .
- Bandmann HJ et Speer U “Red hair after application of Chinoform“ Contact Dermatitis1984 ; 10(2) : 113 .
- Loureiro C et coll . “Red hair and hyperpigmentation in a black man after chemotherapy“ J Clin Oncol 1987 ; 5 (10) : 1705-1706 .
- Nanda A et Alsaleh QA “Hair discoloration caused by etretinate“ Dermatology1994 ; 188 : 172 .
- Ingles RM et Kahn T “Unusual hair changes with minoxidil therapy” Int J Dermatol1983 ; 22 : 120122 .
- Rebora A et Guarrera M “Hair discoloration caused by minoxidil lotion” J Am Acad Dermatol1989 ; 21 (6) : 1314 .
- Callander CC et coll . “Propofol and the colour green“ Anaesthesia1989 ; 44(1) : 82
- Fitzgerald EA et coll . “Green hair discoloration due to selenium sulfide“ Int J Dermatol1997 ; 36 : 238-239 .
- Bessis D et coll . “Straight hair associated with interferon-alpha plus ribavirin in hepatitis C infection“ Br J Dermatol2002 ; 147 : 392-393
- Seçkin D et coll . “Higher incidence of rolled hairs in renal transplant recipients : a possible complication of corticosteroid and cyclosporine therapy“ Acta Derm Venereol 1998 ; 78(5) : 384 .
- Colebunders R et coll . “Curly hair and lipodystrophy as a result of highly active antiretroviral treatment ?“ Arch Dermatol2000 ; 136(8) : 1064-1065 .
- Bunker CB et coll . “Isotretinoin and curly hair“ Clin Exp Dermatol1990 ; 15 : 143-145 .
- Caneppele S et coll . “Cheveux crépus acquis induits par le valproate de sodium“Ann Dermatol vénéreol 2001 ;128 : 134-135.
- Robinson A et Jones W “Changes in scalp hair after cancer chemotherapy“ Eur J Cancer Clin Oncol 1989 ; 25 (1) : 155-156 .
Dernière mise à jour : Septembre 2018
L’acné est une dermatose chronique très fréquente, évoluant par poussée (1).Elle atteint plus de 80% des adolescents(2). Dans cette population il s’agit d’un des motifs de consultation les plus fréquents (6% des séances de consultation) .Cette pathologie guérit le plus souvent spontanément avant l’âge de 20 ans à 25 ans(2). Les adultes en particulier les femmes peuvent en être atteints(1).
L’acné est une maladie des follicules pilosébacés associant :
- Une hypersécrétion sébacée (androgénodépendance).
- Une formation de lésions rétentionnelles secondaire à l’obstruction du canal folliculaire.
- Une formation de lésion inflammatoire dans lesquelles Propionibacterium acnes joue un rôle central (1).
Elle est classée selon le nombre et le type des lésions en : acné légère, modérée et sévère(3).
L’acné est une pathologie où plusieurs facteurs peuvent induire ou aggraver des lésions acnéiformes préexistantes :
- L’hérédité dont le rôle est vraisemblable en cas d’acné sévère, mais très incertain pour les formes légères à modérées.
- Les cosmétiques gras, les goudrons, les produits industriels tels que des huiles de graissage et, les produits chlorés (4).
- Des causes médicamenteuses : certains médicaments peuvent causer des éruptions acnéiques ou aggravent des acnés déjà existantes(5), dans ce cas l’acné prend un aspect monomorphe inflammatoire (6) constituée de papulo-pustules ou les comédons sont absents. L’évolution est particulière avec un début brutal et une régression à l’arrêt du médicament responsable(7).Les médicament en causes sont :
- Des androgènes (tels que la testostérone, le danazol, la prastérone (alias déhydroépiandrostérone ou DHEA).
- Des progestatifs ayant des propriétés androgéniques (tels que la northistérone, le lévonorgestrel, le diénogest).
- Les corticoïdes : quelque soit la voie d’administration, le tétracosactide un analogue de la corticotropine hormone hypophysaire qui stimule les sécrétions surrénaliennes.
- Des antitumoraux (anti-EGFR,inhibiteurs de tyrosine kinase avec un effet anti-VEGF).
- Un cytotoxique : le dactinomycine.
- Des neuropsychotropes : le lithium, certains antiépileptiques tels que la phénytoine, les barbituriques et plus rarement l’acide valproique.
- Un antidépresseur: la tianeptine.
- Certain immunodépresseurs : fréquemment le tacrolimus, l’acide mycophénolique, le sirolimus, et l’évérolimus.
- Des rétinoïdes : l’isotrétinoine avec des cas d’acné fulminantes, une forme grave d’acné, l’adapalène ou le tazarotène surtout au début du traitement (6).
En pratique, l’acné est une pathologie souvent bénigne ayant un retentissement psychosocial généralement important, responsable d’une altération de la qualité de vie, d’étiologies diverses, dont les causes médicamenteuses prennent une part non négligeable(1).
BIBLIOGRAPHIE :
- Afssaps. “Recommandations de bonne pratique ” Traitement de l’acné par voie générale et locale. Lien :https://ansm.sante.fr/content/download/3918/38790/version/6/file/Rbp_Acne-Traitement-voie-locale-generale_2007.pdf
- Application prescrire. “le plus souvent sans gravité” Acné. Rev prescrire 2018 :6.
- S .Robert et coll. “Dermatologie ” le manuel Merck.2014édition de médecine 2014.2177738R :565
- Application prescrire. “L’essentiel sur les soins de premier choix” .Rev prescrire 2017.
- Application prescrire.0322 “Interaction médicamenteuse ” dermatologie .Rev prescrire 2018 :58.
- http://archive.bu.univ-nantes.fr/pollux/fichiers/download/19651c32-83e6-4cd5-be0e-d7093f417395
- http://campus.cerimes.fr/dermatologie/enseignement/dermato_33/site/html/cours.pdf
Dernière mise à jour : Septembre 2018
La formation de calculs biliaires nécessite la conjonction de plusieurs facteurs à savoir : une sursaturation de la bile, une stase vésiculaire et/ou une précipitation de la substance en excès. Ces facteurs peuvent induire une lithiase biliaire. Des médicaments peuvent induire aussi des lithiases biliaires.
Lithiase biliaire non médicamenteuse
Physiopathologie
La lithiase biliaire, est essentiellement représenté par la lithiase vésiculaire(LV), la lithiase de la voie biliaire principale(LVBP) est, dans la très grande majorité des cas, secondaire à la migration de calcule vésiculaire(1).
Les calculs sont soit : cholestérolique (cas le plus fréquent), pigmentaires ou mixtes. Ils sont favorisés par un excès de sécrétion de cholestérol dans la bile (sursaturation), un défaut de sécrétion biliaire des facteurs le solubilisant (phospholipides et sels biliaires) ou une rétention vésiculaire. Ces facteurs augmentent la concentration de cholestérol dans la bile qui va finir par précipiter en lithiase (2).
La lithiase pigmentaire (20% des cas) connait d’autres facteurs : maladies hémolytiques, infections biliaires, sténose des voies biliaires (3).
Facteurs de risques :
Les facteurs de risque de maladie biliaire sont l’âge, le sexe féminin, grossesse, l’obésité, la multiparité, le jeûne prolongé, l’hypertriglycéridémie, mucoviscidose, le diabète, maladies intestinales, la nutrition parentérale (2).
- la lithiase cholestérolique et 2 fois plus fréquente chez la femme entre (40 et 60 ans), que chez l’homme,
- la lithiase biliaire semble être plus fréquente chez les multipares que chez les nullipares (3).
Lithiase biliaire médicamenteuse Il existe plusieurs médicaments qui favorisent la survenue de lithiase biliaire par différents mécanisme, voire le tableau ci-dessous.
| mécanisme | médicaments | Action des médicaments |
|---|---|---|
| Sursaturation de la bile en cholestérol | Contraceptifs oraux et œstrogène | La sursaturation biliaire est expliquée par une augmentation de la synthèse hépatocytaire du cholestérol, par stimulation de l’hydroxyméthyleglutaryl coenzyme A (HMGCoA) réductase et une stimulation des récepteurs membranaires du LDL-cholestérol (4). |
| Clofibrate (hypolipémiant) | l’acide clofibrique (métabolite) augmente l’excrétion biliaire du cholestérol, donc amplifie son taux dans la bile qui devient sursaturée, provoquant des conglomérats cholestéroliques (4). | |
| Ciclosporine (immunosuppresseur) | Par inhibition de la lipase Co A, il en résulte une diminution de la biosynthèse d’acide chénodésoxycholique et une réduction du flux biliaire. elle peut aussi déplacer le cholestérol de ses liaisons, provoquant une précipitation cholestéroliques(4). | |
| Furosémide (diurétique) | Réduction du flux de bile et des sels biliaires ou par augmentation de l’excrétion de calcium dans la bile(4). | |
| Sursaturation de la bile en bilirubine libre | Dapsone (antibiotique de la famille des sulfones) | Les maladies hémolytiques chronique sont reconnues comme facteurs favorisants la lithiase pigmentaire, L’effet indésirable principal est l’hémolyse constante, dose dépendante, Ainsi par le même mécanisme que les anémies hémolytiques, la prise prolongée de dapsone a été incriminée comme facteur favorisant de la lithiase pigmentaire (3). |
| Stase biliaire | Octréotide (apparenté à la somatostatine naturelle) | Il inhiberait la sécrétion de cholécystokinine (CCK) et la sensibilité vésiculaire à la CCK ; il inhiberait aussi la libération de l’acétylcholine au niveau du plexus myentérique vésiculaire. Sur le sphincter d’Oddi. L’Octréotide diminuerait la pression de base, l’amplitude et la durée des ondes de contraction tout en augmentant leur fréquence (3). |
| Progestérone | Pendant la grossesse la progestérone semble être la principale substance responsable des perturbations motrices ; elle présente un effet relaxant déjà connu sur la fibre musculaire lisse (3). | |
| Anti cholinergiques | L’atropine diminue la vidange vésiculaire post prandiale, ainsi que la vidange secondaire à l’administration de CCK exogène. Elle diminue la pression de base du sphincter d’Oddi, la durée, l’amplitude et la fréquence des ondes de contraction (3). | |
| Morphinique | Les opiacés induise une stase vésiculaire par hypertonie du sphincter d’Oddi (3). | |
| Précipitation d’une substance en excès | Ceftriaxone | Des articles récents ont montré le développement de «sludge» ou de concrétions dans la vésicule de patient traités avec cet antibiotique. Ces concrétions disparaissaient après arrêt du traitement et le terme de «pseudolithiase» a été utilisé pour décrire ces phénomènes (3). |
| Dipyridamole (antiagrégant plaquettaire) | La lithogénèse n’a pas été clairement définie (4). |
Bibliographie :
- BOUVENOT.G DEVULDER.B et col pathologie médicale gastro-entérologie ; Masson ; 1995 :314
- https://thoracotomie.com/2014/03/11/lithiase-biliaire-1-physiopathologie-et-colique-hepatique/
- Encyclopédie médicochirurgicale 7-047-A-10
- Lithiase biliaire médicamenteuse – Aurore – Unilim
Dernière mise à jour : Septembre 2018
L’isotrétinoine par voie orale est un rétinoïde dérivé de la vitamine A, a une efficacité démontrée sur l’acné. Elle est commercialisée pour le traitement en deuxième intention des acnés sévères résistant au traitement classique associant antibiotique par voie générale et topique (1).
Elle entraîne de nombreux effets indésirables nécessitant une surveillance renforcée principalement en raison de deux risques majeurs: (2, 3, 4).
- Un risque tératogène connu : elle provoque des atteintes crâniofaciales, cardiaques et du système nerveux central chez environ un quart des enfants exposés in utéro. L’emploi d’une contraception adaptée et la réalisation mensuelle de tests de grossesse encadrent bien ce risque.
- Un risque psychiatrique potentiel : elle expose les patients à des dépressions et des tentatives de suicide.
Les risques de sécheresse cutanée, d’irritation et de fragilisation de l’épiderme et l’hépatotoxicité sont également bien connus (2).
En pratique : l’isotrétinoine par voie orale est un traitement efficace dans l’acné, mais d’utilisation délicate. L’information minutieuse des patients et de leur entourage est importante pour bien encadrer l’usage de ce rétinoïde face aux risques tératogènes et psychiques (5).
Bibliographie :
- ‘‘ Patients sous isotrétinoine’’ Rev Prescrire 2011. 31 (338) :134.
- ‘‘Médicaments de l’acné: à choisir en fonction de la sévérité’’ Rev Prescrire 2009. 29 (313) : 840-841.
- ‘‘Isotrétinoine orale : un carnet de suivi pour chaque patiente traitée’’ Rev Prescrire 2010. 30 (317): 182.
- www.ansm.sante.fr/content/…/1/…/Etude_prescriptions_disotrétinoine_France_mai 2015.pdf.
- ‘‘Isotrétinoine orale : un feuillet patient pour renforcer la prévention de certains risques’’ Rev Prescrire 2012. 32 (344) :419.
Dernière mise à jour : Septembre 2018
Les symptômes de la grossesse ou les signes sympathiques de la grossesse sont ceux qui motivent le plus grand nombre des femmes enceintes pour des consultations, ils revêtent parfois un caractère inquiétant, parmi les symptômes qu’invoquent les femmes enceintes : les nausées les vomissements, le reflux gastro-pesophagien, et les troubles du sommeil.
Tous ces symptômes sont produits par l’effet des hormones sur le cerveau, ils disparaissent rapidement après l’accouchement ou lorsque la grossesse s’interrompt spontanément.
Quand les moyens non médicamenteux ne sont pas suffisants et qu’un médicament semble justifié, le choix est à porter sur le médicament dont l’efficacité est fondée pendant la grossesse et qui n’expose pas la mère ou l’enfant à des risques (1).
Traitement des nausées ou vomissements bénins liés à la grossesse:
Des nausées, accompagnées ou non de vomissements, surviennent chez plus de la moitié des femmes enceintes. Ces troubles sont le plus souvent bénins. Ils débutent en général avant la 8e semaine d’aménorrhée et sont rares après la 22e semaine d’aménorrhée (1.2).
Mesures non médicamenteuse:
- Préférer des aliments appétissants et bien tolérés;
- Prendre fréquemment de petits repas ;
- Boire à distance des repas, de petites quantités et souvent;
- Préférer des repas riches en protéines ou en sucres et pauvres en graisses; (les œufs, la viande maigre, les pates, etc.) ;
- Eviter les odeurs susceptibles de provoquer des nausées;
- Sortir à l’air frais;
- Se reposer en position allongée.
(1.3.4).
Médicaments:
La Doxylamine, un antihistaminique H1 sédatif et atropinique (1), est à proposer à une dose de 15mg le soir au coucher. La dose biquotidienne est augmentée si nécessaire jusqu’à trois prises de 15mg chacune (3), c’est le traitement de premier choix.
Métoclopramide, un neuroleptique, est à proposer, en dernier recours, compte tenu de ses nombreux effets indésirables, parfois graves (1,5).
Autres:
-Gingembre : des études ont montré qu’il n’ya pas d’effet tératogène mais son efficacité reste modeste (6).
-Acupressure ou homéopathie : afin d’éviter le recours aux antiémétiques: l’acupressure (pression manuelle) d’une zone située au niveau de l’avant-bras quelques centimètres du poignet, dite point P6. Permettent parfois de limiter le recours aux antiémétiques (7).
Attention :
Traitemennts à écarter chez une femme enceinte qui a des nausées ou des vomissements bénins:
Dompéridone, métopimazine, méclozine , sétrons (10).
Traitement de reflux gastro-œsophagien au cours de la grossesse :
Chez les femmes enceintes, le reflux gastro-oesophagien est très fréquant (30% à 50%) des grossesses les symptômes débutent dés le premier trimestre et s’intensifient jusqu’à la fin de la grossesse (12,13).
Mesures non médicamenteuse:
- Eviter un mauvais régime alimentaire (graisse, acide, etc.) ;
- Eviter la position allongée, ou penchée ;
- Eviter les vêtements serrés ;
- Perdre du poids est souvent conseillé ;
- Surélever la tête du lit de 10 cm à 15cm.
(8,9).
Médicament:
Un anti acide peut être utilisée au cours de la grossesse lors des épisodes douloureux d’un reflux n’expose pas un risque particulier s’il est utilisé sur une période courte et à dose modérée. Le transite intestinal est un élément de choix de l’anti acide: l’hydroxyde d’aluminium et le phosphalugel en cas de transit accéléré, l’hydroxyde de magnésium et le carbonate de magnésium en cas de constipation, le contenu en sels minéraux des antiacides est à prendre en compte.
En 2eme lieu les inhibiteurs de la pompe à protons tel que l’oméprazole.
(11 12,13).
Traitement des troubles du sommeil:
La grossesse peut être un facteur de survenue d’insomnie par les perturbations psychiques et physiques qu’elle occasionne.
Mesures non médicamenteuses:
- Limiter les facteurs de survenue des troubles du sommeil: consommation d’excitants, repas copieux, activité physique dans les heurs précédant le coucher etc;
- Se coucher seulement quand on sent le sommeil ;
- Utiliser le lit seulement pour dormir ;
- Se lever tous les jours à la même heure.
(14,15).
Médicaments:
La doxylamine, le sédatif le mieux étudié pendant la grossesse.
Les benzodiazépines, très exceptionnellement sur de courtes périodes. À long terme les benzodiazépines exposent à des troubles du comportement, en particulier après une longue exposition.
Utiliser des compléments alimentaires ou des extraits de plantes concentrés à visée médicinale dans le
but d’éviter les médicaments est une stratégie imprudente, dans la mesure ou ces produits sont généralement mal évalués par rapport aux médicaments (16).
Bibliographie :
- ʺpatiente anceintes génées par des nausées-vomissement modérésʺ Rev Prescrire 2013 ; 33 (358) :594-600.
- Refuerzo JS et coll. ʺclinical features and evaluation of nausea and vomiting of pregnancy ʺUpToDate 2017ʺ.
- ʺNausées et vomissements de la grossesse. Privilégier les mesures non médicamenteusesʺ Rev Prescrire 2001 ;21 (223) :838-846.
- Smith JAet coll.ʺTreatement and outcome of nausea and vomiting of pregnancyʺUpToDate 2017.
- “6-1-5 Patients sous modificateur de la motricité”suppl . Inter actions médicamenteuses 2017 ; 37 (401).
- “24-12 Patients sous antihistaminique H1ʺsuppl.Interactions médicamenteuses 2017 ; 37 (401).
- ʺle mal des transportsʺRev préscrire 2008 ; 28 (299) :688.
- “1-10-2-2 Profil d’effets indésirables des sétrons” suppl . Inter actions médicamenteuses 2017 ; 37 (401).
- “Gingembre et nausées de la grossesse. Efficacité modeste, innocuité mal garantie” Rev Prescrire 2008 ; 28 (301) : 849-850.
- “Métoclopramide, dompéridone : morts subites, ary thmies ventriculaires”Rev Prescrire 2016 ; 36 (391) : 351354.
- “Acupuncture. À la recherche d’une efficacité clinique spécifique”Rev Prescrire 2000; 20 (208) : 523-529.
- ” Patientes enceintes ayant un reflux gastro-oesophagien”Rev Prescrire 2015 ; 35 (381) :521-52.
- “Teris Teratogen Information System”.Site interner net rightanswerknowledge.com.
- “Plaintes de mauvais sommeil. Autant que possible, éviter les somnifères” Rev Prescrire 2008 ; 28 (292) : 111-118.
- Prescrire Rédaction.” 19-40 Patients insomniaques Rev Prescrire” 2017 ; 37 (401 suppl. Inter actions médicamenteuses).
- “Insomnia”.In: “Martindale The complete drug reference” The Pharmaceutical Press, London. Site www .medicinescomplete.com consulté le 13 février 2018: 4 pages.
Dernière mise à jour: Septembre 2018
L’alcool benzylique est un alcool aromatique volatile. Il se présente sous forme de liquide incolore, inflammable et irritant. L’alcool benzylique peut être d’origine naturelle (végétale) ou obtenu par synthèse chimique. Il est utilisé dans de nombreux domaines industriels (pharmaceutique, cosmétique, phytosanitaire, alimentaire, etc…) (1).
Dans le domaine pharmaceutique, l’alcool benzylique, en association à la chlorhexidine et au chlorure de benzalkonium, est utilisé comme antiseptique des plaies chirurgicales et traumatiques peu profondes (1,2). Il joue également le rôle d’excipient, faisant part de la composition d’un grand nombre de médicaments injectables. Il peut aussi être un agent de conservation de divers solutions, telles que les ‘solutions salines’(1) (3).
La prescription aux nouveau-nées de produits pharmaceutiques contenant de l’alcool benzylique, est-elle sans danger ?
Les trois approches présentées ci-dessous permettent de répondre à cette problématique :
- L’alcool benzylique, antiseptique contenu dans les solutions pour application locale :
L’utilisation de solutions de chlorhexidine, alcooliques ou aqueuses, pour l’antisepsie de la peau, avant une intervention invasive a été associée à des brûlures chimiques chez des nouveau-nés.
En l’absence de données sur la résorption cutanée, le risque d’effets systémiques ne peut être exclu. Ils sont d’autant plus à redouter, que l’antiseptique est utilisé sur une grande surface, sous pansement occlusif, sur une peau lésée (notamment brûlée) ou une muqueuse de prématuré ou de nouveau-né (2).
- L’alcool benzylique, excipient contenu dans les solutions injectables en ampoules :
Des spécialités injectables peuvent contenir de l’alcool benzylique, notamment le clonazepam, un antiépileptique indiqué dans le traitement d’urgence de l’état de mal épileptique de l’adulte et de l’enfant.
Certaines spécialités de ce principe actif contiennent 30 mg/ml d’alcool benzylique (excipient à effet notoire). L’administration intraveineuse d’alcool benzylique a été associée à des effets indésirables graves et à la mort chez les nouveau-nés (« syndrome de suffocation »). La quantité minimale d’alcool benzylique susceptible d’entraîner une toxicité n’est pas connue. Il convient donc de ne pas l’utiliser chez le nouveau-né (jusqu’à 4 semaines)(3).
Une autre benzodiazépine, le diazépam utilisée comme anxiolytique doté de propriétés sédatives, hypnotiques, anticonvulsivantes et amnésiantes. Il est indiqué dans le traitement des crises convulsives par voie rectale du nourrisson et de l’enfant.
Comme le clonazepam, certaines spécialités du diazépam contiennent environs 15.7 mg/ml d’alcool benzylique, et sont donc contre-indiquées chez le nouveau-né (4).
- L’alcool benzylique, agent de conservation contenu dans les solutions saline utilisées lors de la préparation des poches pour perfusion :
Le blinatumomab est un anticorps monoclonal indiqué dans le traitement de la leucémie aiguë lymphoblastique chez les adultes et les enfants.
En raison de l’ajout de solution saline bactériostatique, les sacs de solution de blinatumomab pour perfusion sur une durée de 7 jours, contiennent de l’alcool benzylique comme agent de conservation.
Des événements indésirables graves et des décès (y compris le « syndrome de respiration haletante ») liés à l’alcool benzylique, peuvent se produire chez les enfants, plus particulièrement chez les nouveau-nés ayant reçu la solution pour perfusion de blinatumomab.
Le « syndrome de respiration haletante » est caractérisé par une respiration superficielle, une dépression du système nerveux central, une acidose métabolique et des taux élevés d’alcool benzylique et de ses métabolites dans le sang et l’urine. Ce syndrome survient à des doses d’alcool benzylique supérieures à 99 mg/kg/jour chez les nouveau-nés, ayant un faible poids à la naissance.
Pour préparer les sacs de solution pour perfusion destinée aux nouveau-nés, il est recommandé aux professionnels de la santé d’utiliser une solution saline exempte d’agent de conservation (5,6).
Conclusion,
Il convient de souligner la dangerosité de l’usage des produits contenant de l’alcool benzylique chez les nouveau-nés. Qu’il soit antiseptique, excipient à effet notoire ou agent de conservation, cet alcool est contre-indiqué chez cette tranche d’âge de la population.
Annexe : Schéma récapitulatif des rôles de l’alcool benzylique et des conséquences de son utilisation chez le nouveau-né (1-6).
BIBLIOGRAPHIE
- “Journal des femmes. Rubrique : Santé. Alcool benzylique : utilisation, danger, allergie, c’est quoi ?”. https://sante.journaldesfemmes.fr/fiches-medicaments/2784233-alcool-benzylique-utilisation-danger-allergie-pharmacie-injectable-chlorhexidine. 14 février 2022 (cité le 12 juin 2022) : 02 pages.
- ANSM.”RCP- Chlorhexidine / Benzalkonium / Alcool benzylique 0.25 g / 0.025 g / 4 ml pour 100 ml solution pour application locale”. Mise à jour le 13 Octobre 2021 : 03 pages.
- ANSM. “RCP- Clonazepam Rivotril 1mg/1ml solution à diluer injectable”. Mise à jour le 02 Décembre 2021 : 07 pages.
- ANSM. “RCP- Diazépam 10mg/2ml solution injectable “. Mise à jour le 02 Mai 2022. Consulté le 22 juin 2022 : 09 pages.
- Site officiel du Gouvernement du Canada. “Communication des risques pour les professionnels de la santé : Blinatumomab et la toxicité de l’alcool benzylique chez l’enfant”. https://recalls-rappels.canada.ca/fr/avis-rappel/blincyto-blinatumomab-et-toxicite-alcool-benzylique-chez-enfant-0. 12 juin 2018 : 05 pages.
- Amgen Canada. Monographie “Blinatumomab poudre lyophilisée pour solution pour perfusion 38,5 microgrammes”. Mise à jour le 06 Mai 2021 : 75 pages.
Dernière mise à jour : Septembre 2022
Complexe d’hydroxyde ferrique – saccharose exprimé en fer élément 100 mg / 5ml, solution pour perfusion IV.
Les recommandations d’utilisation de ce produit regroupent les rubriques suivantes :
Indications :
- Traitement de l’anémie par carence martiale, lorsque l’administration par voie orale est impossible, et seulement si l’indication est confirmée par des examens appropriés ;
- Traitement de l’anémie chez l’insuffisant rénal chronique hémodialysé ;
- En situation pré-opératoire : chez les patients inclus dans un programme de don de sang autologue en association avec l’érythropoïétine ;
- En situation post-opératoire (dans l’immédiat) : en traitement des anémies aiguës ;
- Traitement des anémies hyposidérémiques par carence martiale liées aux maladies inflammatoires chroniques sévères de l’intestin [1,2,3].
Posologie :
La posologie par injection ne doit pas dépasser 300 mg chez l’adulte [1,2].
La dose totale à administrer et le rythme des injections dépendent du poids, du taux d’hémoglobine, de la ferritinémie basale et de la perte de fer attendue. À chaque indication correspond une formule bien déterminée pour le calcul de cette dose, ainsi qu’une posologie recommandée bien définie [1,2,3].
Mode d’administration :
- Par perfusion intraveineuse :
- Le produit ne doit être utilisé qu’après dilution immédiate avant la perfusion, exclusivement dans une solution isotonique stérile de chlorure de sodium à 0.9 %, à raison de 5 mL (100 mg de fer) dilué dans un maximum de 100 mL de solution isotonique, jusqu’à 15 mL (300 mg de fer) dilués dans un maximum de 300 mL de solution pour perfusion.
- La concentration en fer de la solution résultante ne doit pas être inférieure à 1 mg/mL.
- La perfusion doit être lente avec un débit de 3.5 mL/minute (administrée en au moins 1 heure 30 minutes).
- S’assurer que l’aiguille est bien positionnée dans la veine avant de pratiquer la perfusion, afin d’éviter les risques liés à une extravasation au site d’injection.
- Administrer une solution saline isotonique avant la perfusion pour vérifier le positionnement de la canule et rincer à nouveau avec du sérum physiologique une fois la perfusion ou le bolus terminé.
- Une surveillance infirmière doit être réalisée régulièrement à 15 minutes, 30 minutes puis toutes les heures jusqu’à la fin de la perfusion.
- Etendre le bras du patient après la perfusion.
- Lors du traitement des anémies post-opératoires et des anémies liées aux maladies inflammatoires chroniques de l’intestin, l’intervalle minimum entre chaque administration est de 48h, il doit être strictement respecté [1,2].
- Injection dans la ligne veineuse du dialyseur : L’injection est possible, dans les mêmes conditions que pour une perfusion [1,2].
Mises en garde spéciales:
- Surveiller attentivement les patients afin de détecter tout signe ou symptôme de réactions d’hypersensibilité pendant et 30 minutes après la fin de la perfusion, d’autant plus si les patients présentent des allergies médicamenteuses ou sont atteints de troubles immunitaires ou inflammatoires.
- Le produit doit être administré uniquement par du personnel formé pour évaluer et prendre en charge les réactions anaphylactiques, en présence de moyens nécessaires pour assurer une réanimation cardio-respiratoire incluant l’adrénaline injectable, les antihistaminiques, et les glucocorticoïdes.
- Si des manifestations d’hypersensibilité sont observées durant l’administration, le traitement doit être immédiatement arrêté [1,2,3].
- Evaluation attentive du rapport bénéfices/risques chez les patients présentant une insuffisance hépatique [1,2,3].
- Utilisation avec précaution en cas d’infection aiguë ou chronique, en raison du risque d’aggravation des infections [1,2,3].
- Des réactions d’extravasation au site d’injection peuvent survenir et se manifester par une inflammation, une douleur, une rougeur etc…Si une extravasation survient, la perfusion doit être arrêtée immédiatement [1,2,3].
- Chez les sujets préalablement traités par le fer par voie orale, ce traitement doit être interrompu 24 h avant la première injection du fer [1,2,3].
- L’association du fer injectable avec les sels de fer injectables est déconseillée. Il y a risque de libération rapide du fer de sa forme complexe et de saturation de la sidérophiline [1,2,4].
Effets indésirables :
Les effets indésirables fréquents (≥1/100, <1/10) sont : nausées, dysgueusie, hypotension, hypertension, réactions au point d’injection/de perfusion (douleur au point d’injection/de perfusion, œdèmes, brûlure, irritation, coloration, hématome, prurit) [1,2].
Contre-indications :
- Hypersensibilité à la substance active ou à toute préparation parentérale ;
- Anémie non ferriprive ;
- Surcharge martiale (hémochromatose) ;
- Cirrhose hépatique décompensée [1,2].
BIBLIOGRAPHIE
- Résumé des Caractéristiques du Produit (RCP) Hydroxyde ferrique-Saccharose 100mg/5ml, mis à jour le : 31/12/2021.
- Résumé des Caractéristiques du Produit (RCP) Hydroxyde ferrique-Saccharose 100mg/5ml, mis à jour le : 01/12/2021.
- Vidal en ligne, Hydroxyde ferrique-Saccharose 20mg/ml, mis à jour le : 17/02/2022.
- Thésaurus des interactions médicamenteuses de l’ANSM, Version : Octobre 2020.
Dernière mise à jour : Octobre 2022
Suite aux effets toxiques parvenus au CNPM, une revue de la littérature et recueil d’avis d’experts, des recommandations d’utilisation du méthotrexate à forte dose (MTX-HD)ont été émises, qui sont :
Posologie et mode d’administration :
- Calculer la posologie par m² de surface corporelle ou en fonction du poids corporel.
- Les recommandations d’utilisation et de posologie duMTXvarient considérablementselon les indications. De ce fait, les protocoles actuellement publiés doivent être consultés. À titre d’exemples : le FRALLE 2000 pour les patients atteints de LAL, le guide de Suivi Thérapeutique Pharmacologique de Pierre Marquet… [1-5].
Interactions médicamenteuses :
- L’ensemble des interactions médicamenteuses du méthotrexate doit être pris en compte de façon générale avant l’initiation du traitement [3,4].
- Les principaux médicaments susceptibles d’interférer sur la fonction rénale et d’augmenter la toxicité du méthotrexate, et suivant le niveau de contrainte de leur association au MTX, sont [1,3,4,5] :
- Association contre-indiquée : acide acétylsalicylique (à des doses antalgiques, antipyrétiques ou antiinflammatoires), triméthoprime (seul ou associé au sulfaméthoxazole), probénécide.
- Association déconseillée: AINS, IPP, ciprofloxacine, pénicillines, phénytoïne, fosphénytoïne.
- Association faisant l’objet deprécaution d’emploi : acide acétylsalicylique (à des doses antiagrégantes plaquettaires).En cas d’association du MTX avec de la ciclosporine, il y a une augmentation du risque de toxicité du MTX et de la ciclosporine par diminution réciproque des clairances des deux médicaments. Il est nécessaire de réaliser un dosage des concentrations plasmatiques de ciclosporine et de MTX pour adapter la posologie s’il le faut pendant l’association et après son arrêt.
- Certains médicaments doivent être arrêtés suffisamment tôt en fonction de leur demi-vie pour éviter toute interférence avec l’élimination du MTX-HD [3,4].
- D’autres médicaments peuvent interagir avec le MTX par diminution du pH urinaire, tels que : le furosémide et la vitamine C [4].
- Enfin, lors de l’administration conjointe du MTX-HD et de médicaments ayant une toxicité rénale propre notamment les produits de contraste iodés, aminosides, organoplatines, antiviraux (exemple le foscarnet), pentamidine, les immunosuppresseurs, etc. il existe un risque d’augmentation de la néphrotoxicité par synergie d’effet[1] [3,4]
NB : la liste des interactions médicamenteuses présentée ci-dessus n’est pas une liste exhaustive. Il est indispensable à tout praticien de santé de se référer au Résumé des Caractéristiques du Produit (RCP) de la spécialité du MTX-HDpour plus de détails.
Evaluation de la fonction rénale :
- Vérifier l’existence d’une éventuelle atteinte rénale avant l’initiation du traitement. Il peut notamment être utile de calculer le ratio protéinurie/créatininurie ou albuminurie/créatininurie sur échantillon d’urines [3,4].
- Dans les 72 heures précédant chaque administration de MTX-HD, il est indispensable d’effectuer une estimation du débit de filtration glomérulaire (DFG). Utiliser la formule de Schwartz si le patient est âgé entre 01 et 25 ans [4].
- Surveiller la fonction rénale par des mesures quotidiennes de la créatinine sérique, pendant et/ou après l’administration de MTX-HD [1,3,4]. Une augmentation précoce de la créatininémie > 1,5 fois la valeur basale, doit systématiquement faire évoquer un retard à l’élimination [4].
Hydratation et alcalinisation des urines :
- Assurer une hydratation par des solutés de glucose 5 % et/ou duNaCl 0,9 %, en plus de l’hydratation orale du patient (au moins 03 litres par jour) [3].
- Assurer une alcalinisation par des solutions de bicarbonate de sodium, avant l’initiation du traitement et avant chaque cure [3,4].
- Le délai d’initiation de l’hydratation alcaline peut varier de 2h à 24h [4].Il est recommandé que le pH urinaire soit supérieur à 7 avant de débuter le MTX-HD [3,4]. Ce pHdoit être mesuré par bandelettes urinairesau minimum toutes les 6 heures et si possible à chaque miction, avant et pendant l’administration de MTX-HD jusqu’à élimination satisfaisante du MTX [4].
- Maintenir un pH urinaire supérieur à 7 pendant et/ou après l’administration de MTX-HD[3,4]. Une alcalinisation secondaire peut être envisagée quand le pH urinaire n’est pas satisfaisant [3,4].Un nouveau contrôle du pH doit être effectué 1 heure après [4].
- Surveiller la diurèse[1,3,4],en maintenant le débit urinaire à un minimum de2,5 L/m²/jour et en contrôlant le poids du patient [4].
- Si retard d’élimination du MTX-HD, assurer le maintien d’une diurèse alcaline suffisante et surveiller la fonction rénale[3,4].
Supplémentation en acide folinique :
- L’acide folinique est indiqué dans la prévention et/ou la correction des accidents toxiques provoqués par le méthotrexate[1,4], ilest préconisé après un traitement par MTX-HD. Le schéma posologiqueest dicté par le protocole établi dans l’indication concernée et dépend fortement de la posologieet de la méthotrexatémie[3,4].
- Selon la posologie du MTX : Des doses de méthotrexate supérieures à 100 mg requièrent toujours l’administration ultérieure d’acide folinique[1]. L’acide folinique étant un antagoniste du MTX, il ne doit pas être administré en même temps que le MTX sauf dans le cas de protocoles précis. L’intervalle entre l’administration de MTX-HD et le début de traitement par l’acide folinique doit être respecté [4].
- Selon la méthotrexatémie : L’administration d’acide folinique doit être poursuivie jusqu’à l’atteinte d’un seuil désiré en concentration plasmatique de MTX, qui peut différer selon le protocole d’administration [1,4].
En cas de surdosage en MTX, administrer systématiquement et le plus tôt possible l’acide folinique,car son efficacité est d’autant plus importante qu’il est administré précocement [3,4]. La posologie sera adaptée en fonction des taux plasmatiques résiduels de méthotrexate et ceux-ci doivent déterminer la durée optimale du traitement [4,5].
Dosage sanguin du MTX :
- Le dosage du MTX est capital pour plusieurs raisons, notamment pour la détermination de la dose et la durée d’administration de l’acide folinique [5].
- Le résultat du dosage du MTX doit être disponible dans les heures qui suivent le prélèvement [4].
- Le dosage doit se faire sur sérum ou sur plasma (selon l’automate disponible et la méthode analytique suivie), en respectant les intervalles de mesures de la méthotrexatémie notés comme suit [4] :
| Indication Paramètre | LAL | Ostéosarcome | Lymphome |
|---|---|---|---|
| Durée de la perfusion | 24-36h | 4h | 2-6h pouvant aller jusqu’à 24h |
| Intervalles de mesurede la méthotrexatémieaprès le début de la perfusion | 48h, 72h (plus ou moins 36h) | 24h, 48h, 72h (plus ou moins 96h) | 24h, 36h (dans le cadre d’une perfusion de 24h), 48h (plus ou moins 72h) |
Risque d’erreur médicamenteuse :
Tout praticien de santé s’apprêtant à préparer et/ou injecter le MTX à un patient doit êtretrès vigilant au dosage et à la concentration mentionnés sur le conditionnement. Ceci permettra d’éviter tout risque d’erreur médicamenteuse [6].
Intoxication au MTX :
- Dans certaines situations d’intoxication sévère au MTX-HD, le recours à la glucarpidase peut êtreenvisagé [4]. Appelée aussi carboxypeptidase G2 (CPG2), cette enzyme est indiqué pour réduire la concentration plasmatique toxique du MTX, chez les adultes et les enfants (à partir de 28 jours) présentant une élimination retardée ou un risque de toxicité du MTX [3,4] [7,8].
- La CPG2 est une enzyme recombinante qui hydrolyse le résidu glutamate terminal des molécules de la famille des folates comme le tétrahydrofolate ou ses analogues, dont le MTX fait partie. La CPG2 convertit ainsi la fraction libre du MTX circulant en métabolite inactif [7].
- La dose recommandée est une dose unique de 50 unités par kilogramme (kg) sous forme de bolus intraveineux pendant 5 minutes [3,8].
- Une fois le diagnostic d’élimination retardée du MTX ou de risque de toxicité du méthotrexate établi, la glucarpidase doit être administrée sans tarder. La fenêtre temporelle optimale d’administration est de 48 à 60 heures à partir du début de la perfusion de MTX-HD [8].
- À noter quel’acide folinique est un substrat compétitif de la glucarpidase susceptible de se lier aux sites de liaison du MTX. Il est donc conseillé de ne pas administrer cet acide dans les 2 heures précédant ou suivant l’administration de la glucarpidase afin de minimiser le risque d’une éventuelle interaction[3,8].
Bibliographie :
- ANSM-RCP :METHOTREXATE 100 mg/ml, solution injectable. 09/12/2023 : 12 pages.
- FRALLE 2000 version 2005.
- Institut National du Cancer. MESURES DE PRÉVENTION ET DE GESTION DE LA TOXICITÉ RÉNALE INDUITE PAR LE MÉTHOTREXATE HAUTE-DOSE/Avis d’experts. Juin 2023. [cité le 09/11/2023]. Disponible sur : https://www.e-cancer.fr/Expertises-et-publications/Catalogue-des-publications/Mesures-de-prevention-et-de-gestion-de-la-toxicite-renale-induite-par-le-methotrexate-haute-dose-Avis-d-experts
- ANSM-Informations de sécurité.Méthotrexate haute dose (MTX-HD) : l’ANSM rappelle les mesures générales de prévention du risque de néphrotoxicité. [En ligne].11/07/2023. [Cité le 26/03/2024]. Disponible sur : https://ansm.sante.fr/informations-de-securite/methotrexate-haute-dose-mtx-hd-lansm-rappelle-les-mesures-generales-de-prevention-du-risque-de-nephrotoxicite
- Marquet P, Carpentier N, Milano G, Thyss A, Favre R. Suivi thérapeutique pharmacologique du méthotrexate. EMC – Biologie Médicale. janv 2006;1(1):1‑4.
- Séminaire Approfondi en Pharmacovigilance (SAP). Les erreurs médicamenteuses et autres problème liés au médicament Erreurs médicamenteuses. Session : Février 2024.
- Utilisation de la glucarpidase dans les intoxications au méthotrexate | Institut national de santé publique du Québec [en ligne]. [citéle 3 avr 2024]. Disponible sur: https://www.inspq.qc.ca/toxicologie-clinique/utilisation-de-la-glucarpidase-dans-les-intoxications-au-methotrexate
- ANSM-RCP :Glucarpidase (Voraxaze) 1 000 unités poudre pour solution injectable. 26 pages.
Dernière mise à jour : Juillet 2024
Le syndrome de Lyell ou nécrolyse épidermique toxique est une forme extrêmement grave d’allergie médicamenteuse. Il se caractérise par une destruction aiguë et étendue de l’épithélium de la peau et des muqueuses.
Cela se traduit cliniquement par des macules centrées par des vésicules, confluant en nappes érythémateuses sur lesquelles l’épiderme se décolle spontanément ou au moindre traumatisme (signe de Nikolsky). À ce tableau s’associent presque constamment des lésions muqueuses.
Les manifestations viscérales sont fréquentes, avec notamment des atteintes hématologiques, respiratoires et digestives.
La maladie est grave, avec une mortalité de l’ordre de 30 % et un risque important de séquelles, en particulier oculaires.
L’aspect clinique, le terrain et surtout l’histologie cutanée permettent de la différencier de l’épidermolyse staphylococcique.
Un médicament peut être imputé de manière plausible dans 70 % des cas environ, essentiellement les sulfamides antibactériens, de nombreux anticomitiaux, l’allopurinol, certains anti-inflammatoires non stéroïdiens et la névirapine.
La physiopathologie reste mal connue, liée à un processus immunologique probablement cytotoxique à médiation cellulaire.
Le traitement, essentiellement symptomatique, est au mieux conduit en unité de soins intensifs (1).
Cas clinique :
Un cas clinique nous ait parvenue depuis un centre Hospitalo-universitaire à Alger.
Résumé du cas clinique :
Patient L. S. âgé de 13 ans et pesant 48 kg, sans antécédents pathologiques ou allergiques particuliers.
Le 14/07/2018, il présente un syndrome grippal. Ses parents le mettent sous acide acétyl-salicylique sachet de 500 mg (dans le cadre d’une automédication).
Vu l’aggravation des symptômes, les parents ramènent l’enfant en consultation le 15/07/2018. Son médecin traitant lui prescrit de l’amoxicilline-acide clavulanique à raison de 500 mg 3 fois par jour et du paracétamol 500 mg 3 fois par jour.
Le 16/07/2018, apparition d’une éruption maculo-papuleuse en pseudo-cocarde intéressant le visage et la partie supérieure du tronc.
Le 17/07/2015, les parents reconsultent et le médecin traitant décide d’arrêter l’amoxicilline-acide clavulanique et de prescrire l’azithromycine associé à un corticoïde et un anti-histaminique.
Le 18/07/2018, apparition d’une conjonctivite, d’une érosion muqueuse au niveau de la bouche et aggravation des lésions cutanées (vésicules et desquamation de la peau).
Le 19/07/2018, l’enfant est hospitalisé en réanimation pédiatrique pour prise en charge. Un syndrome de Lyell sous amoxicilline-acide clavulanique est suspecté.
L’enfant a reçu des Immunoglobulines en IV à raison d’ 1g/kg/j pendant 3 jours.
Il a reçu également des soins locaux : soins cutanés un jour sur deux et soins oculaires, buccaux et génitaux pluriquotidiens.
Le 12/08/2018, sortie du patient après 25 jours d’hospitalisation. Les lésions cutanées ont bien évolué, hormis des dyschromies.
L’atteinte oculaire est plus sérieuse : opacité cornéenne à droite avec un ulcère cornéen et des symblepharons à gauche (prise en charge en ophtalmologie, cyclines+corticoides).
L’enfant a été orienté en chirurgie plastique pour le suivi des séquelles cutanées.
Conclusion :
Après imputabilité des médicaments administrés chez ce patient et consultation des données de la recherche bibliographique, nous avons tiré les conclusions suivantes :
La sémiologie clinique et paraclinique, la chronologie ainsi que les données bibliographiques plaident en faveur du rôle de l’Amoxicilline-Acide Clavulanique dans le développement du syndrome de Lyell chez ce patient.
L’administration de l’Azythromycine aurait favorisé le développement, voire l’aggravation des lésions cutanées.
Les autres médicaments pris par ce patient (Acide acétylsalicylique, Paracétamol) peuvent être considérés comme facteurs favorisant possibles.
Référence :
(1). http://www.em-consulte.com/article/67008/syndrome-de-lyell-necrolyse-epidermique-toxique.
Dernière mise à jour : Octobre 2018
La flammazine, un sulfamide local commercialisé pour le traitement antiseptique d’appoint des plaies infectées, des brûlures et pour le traitement d’appoint des affections dermatologiques primitivement bactériennes ou susceptibles de se surinfecter (1).
Les effets indésirables les plus fréquents de la Flammazine® sont les effets cutanés (eczéma, réactions eczématiformes, éruptions, troubles pigmentaires, réactions bulleuses). Des cas de cytopénie (leucopénie, neutropénie, agranulcytose), d’argyrie*, et d’insuffisance rénale sont également rapportés (1,2).
La réévaluation par l’ANSM de la balance bénéfices/risques des spécialités à base de sulfadiazine argentique a conduit à (2) :
- Une suppression de l’indication de Flammazine dans le traitement d’appoint des affections dermatologiques primitivement bactériennes ou susceptibles de se surinfecter ;
- Une restriction de son utilisation aux adultes et aux enfants de plus de 2 mois, en prévention et en traitement des infections dans le cadre de la prise en charge des brûlures à partir du deuxième degré.
En conséquence, des recommandations de bon usage de flammazine ont été émises à savoir (2) :
- Elle ne doit pas être utilisée sur des plaies qui ne sont pas des brûlures ;
- Elle est contre-indiquée chez l’enfant de moins de 2 mois (prématuré, nouveau-né, nourrisson de moins de 2 mois) ;
- Elle doit être utilisée avec prudence chez l’enfant de moins de 2 ans en raison du risque de passage systémique accru dans cette catégorie d’âge qui expose au risque de complications générales des sulfamides ;
- Elle est contre-indiqué pendant l’allaitement si l’enfant a moins d’un mois en raison de l’immaturité du système enzymatique dans cette population et du risque consécutif d’ictère nucléaire ;
- Elle est contre-indiquée pendant l’allaitement si l’enfant est atteint d’un déficit en G6PD, afin de prévenir la survenue d’une hémolyse.
En pratique : le respect des recommandations de bon usage de flammazine est primordial pour éviter les effets indésirables évitables.
Bibliographie :
- ANSM “RCP Flammazine”. Consulté le 11/04/2020. 05 pages.
- ANSM “Flammazine (crème de sulfadiazine argentique) : ne pas utiliser sur les plaies autres que les brûlures, et réserver son utilisation à l’adulte et l’enfant de plus de 2 mois”. www.ansm.santé.fr. Consulté le 11/04/2020. 02 pages.
*argyrie : dermatose résultant d’un contact prolongé avec des sels d’argent ou de leur ingestion, la couleur tourne au gris bleuté.
Généralités:
Le paracétamol et l’ibuprofène font parti des médicaments les plus largement prescrits en pédiatrie depuis l’association: Acide Acétyle Salicylique AAS (Aspirine®) et syndrome de Reye. La disponibilité de ces médicaments sans ordonnance contribue à un usage large et parfois injustifié.
Le paracétamol et l’ibuprofène sont tous deux réputés pour leur excellent profil de tolérance et une marge thérapeutique large, mais ils ne sont pas pour autant dépourvus d’effets indésirables.
Indications:
Les indications reconnues du paracétamol et de l’ibuprofène sont le traitement de la fièvre et des douleurs légères à modérées. L’ibuprofène comme traitement d’affections rhumatismales.
Mécanisme d’action:
1. Paracétamol :
Le mécanisme d’action du paracétamol n’est pas complètement élucidé. Il a été démontré que son action analgésique intervient de manière prédominante au niveau du système nerveux central et en périphérie. Son activité pharmacologique du paracétamol résulte d’une inhibition des cyclo-oxygénases (COX-1 et COX-2), d’une manière semblable aux AINS.
Le paracétamol a essentiellement une activité analgésique et antipyrétique, il possède une légère activité anti-inflammatoire.
Sa demi-vie est brève (2,7 heures) et son élimination se fait après métabolisme (glucuronidation et sulfonation, une fraction mineure subit une oxydation), les métabolites formés sont ensuite excrétés par voie rénale. L’oxydation est responsable de la formation du métabolite (N-acétyl-p-benzoquinone imine) associé à l’hépatotoxicité, qui doit ensuite être inactivé par conjugaison au glutathion pouvant causer des lésions cellulaires.
2. Ibuprofène:
L’ibuprofène est un anti-inflammatoire non stéroïdien non sélctif. Il inhibe les cyclo-oxygénases (COX-1 et COX-2). Son action anti-inflammatoire, antalgique et antipyrétique est principalement attribuée à l’inhibition de la COX-2, alors que les effets indésirables digestifs sont dus à l’inhibition de la COX-1.
Sa demi-vie plasmatique est courte (2 heures). Il est principalement métabolisé au niveau hépatique par oxydation et glucuronidation puis ses métabolites inactifs sont excrétés par voie rénale.
Traitement de la fièvre chez l’enfant :
La fièvre est une réponse physiologique de l’organisme, qui a pour but d’optimiser la réponse immunologique contre une infection. Les recommandations actuelles ne préconisent pas de traiter la fièvre chez l’enfant de manière systématique mais plutôt pour son confort.
La voie orale est conseillée d’une manière générale, en raison d’une absorption plus prévisible et donc d’une meilleure efficacité.
La prescription d’un schéma alterné de paracétamol et d’ibuprofène est une pratique courante en pédiatrie. La littérature à ce sujet a récemment fait l’objet d’une revue Cochrane et conclut à une efficacité antipyrétique légèrement supérieure lors d’administration des deux médicaments combinés ou alternés.
Les recommandations actuelles proposent donc de
limiter cette pratique en cas de non-réponse à une monothérapie
, car une incertitude persiste quant aux respects de sécurité de cette association.
Traitement de la douleur chez l’enfant:
Il n’existe à ce jour pas d’étude antalgique entre paracétamol et ibuprofène.
Une méta-analyse aux méthodes statistiques contestées a conclu que l’efficacité antalgique d’une dose unique de paracétamol (7-15 mg/kg) ou d’ibuprofène (4-10 mg/kg) n’était pas différente après extraction dentaire ou lors du traitement de maux de gorge chez des enfants, une légère tendance en faveur d’une efficacité supérieure de l’ibuprofène est néanmoins rapportée.
Profil d’effets indésirables:
1. Paracétamol:
Les effets indésirables du paracétamol se limitent à quelques cas exceptionnels d’allergie. Son seul autre risque est celui d’une surdose massive. Il peut être associé sans risque particulier avec pratiquement tous les autres médicaments d’usage courant chez l’enfant.
2. Ibuprofène:
L’ibuprofène fait courir un risque bien plus élevé que le paracétamol comme le risque d’allergie (asthme, réaction cutanée sévère), un saignement digestif, une infection grave de la peau, un risque d’infection généralisée rare mais parfois mortelle, un risque de complications graves (méningite, encéphalopathie) lors du traitement de certaines maladies virales (varicelle), un risque pour le fonctionnement du rein (notamment en cas de déshydratation), etc.
Une surdose en ibuprofène provoque également des effets indésirables graves, particulièrement chez les jeunes enfants.
En pratique :
Le traitement pharmacologique de la fièvre devrait être dicté par le confort de l’enfant avant tout et non par la recherche d’une température corporelle normale à tout prix.
La combinaison paracétamol et ibuprofène est à réserver aux enfants ne répondant pas à une monothérapie.
Le paracétamol reste le meilleur traitement de la fièvre chez les enfants, efficace dans la plupart des cas, avec un très faible risque d’effets indésirables. Il est aussi efficace contre la plupart des douleurs.
L’ibuprofène fait baisser la fièvre à peine plus vite que le paracétamol. Son efficacité sur la douleur semble identique.
En cas de fièvre ou de douleur chez l’enfant, le traitement de premier choix est donc le paracétamol à dose adaptée au poids de l’enfant: 15 mg/kg toutes les 6h.
Réf :
- Fièvre des enfants: en rester au paracétamol « Revue Prescrire 2009;29 (309): 526.
- Revue « paediatrica », vol 27. N°.2.2016.
Dernière Mise à jour : Novembre 2017
Un excipient est une substance contenue ou présente dans un médicament, autre que la substance active, destinée à apporter une consistance, un goût, une couleur à un médicament, tout en évitant toute interaction avec le principe actif. Un excipient peut notamment être un solubilisant ou un conservateur.
Un excipient doit être « inerte », il ne devrait avoir aucun effet notable mais ce n’est pas toujours le cas, certains sont qualifiés d’excipients « à effets notoires ». (Voir annexes). Ils sont toujours mentionnés à part dans la composition du médicament afin d’être repérés facilement et permettre de prendre les précautions qui s’imposent. (11)
La sélection des excipients est une étape clé car certains excipients présents dans les formulations pour adultes peuvent être inappropriés chez l’enfant. (8)
Adapter les médicaments aux enfants impose parfois aussi d’adapter la forme pharmaceutique, notamment buvable, et de choisir les excipients à bon escient (non toxiques et en quantité limitée), Or les excipients exposent à des effets indésirables, soit par eux-mêmes, soit en majorant l’absorption induisant des effets indésirables de certains médicaments. (9)
L’innocuité de ces excipients n’est pas toujours garantie et des accidents sont survenus chez l’enfant suite à l’administration d’excipients qu’il ne tolère pas à savoir : (1)
| Type d’excipient | Effets indésirable | Recommandations d’utilisations |
|---|---|---|
| Dérivés terpéniques | Neurologiques | la Commission d’AMM européenne (CHMP) a recommandé leur contre-indication en-dessous de 30 mois dans les suppositoires et chez les enfants ayant des antécédents d’épilepsie, de convulsions fébriles ou souffrant de lésions anorectales, potentiellement graves, en raison du risque de convulsions connu depuis longtemps. (2). Néanmoins on en trouve encore sur le marché dans d’autres formes destinées aux enfants. En Algérie, le CNPM avait recommandé qu’il était plus prudent, d’utiliser chez les enfants des mesures non médicamenteuses (hydratation,hygiéne,etc) pour des affections bronchiques bénignes |
| Propylène Glycol | – Dépression du système nerveux central – Pression osmotique élevée causant des effets laxatifs (3,4) | Les médicaments contenant de fortes concentrations en propylène |
| Chlorure de benzalkonium , (agent conservateur dans les préparations antiasthmatiques. (1). | Allergie | |
| L’alcool benzylique (conservateur) (injection IV) | – Gasping Syndrome (collapsus cardio-vasculaire) – Troubles du rythme respiratoire, – Hypotension | |
| Le lactose | – Diarrhées, – Crampes abdominales – Flatulences chez des enfants déficients en lactase. (1) | |
| -Crémophors, -Parabens, -Thiomersal (5). | Bronchospasmes |
En pratique , les enfants sont trop peu protégés vis-à-vis des effets indésirables des excipients. Or ils y sont particulièrement exposés par :
- Les formes pédiatriques buvables ;
- Les usages hors AMM de médicaments développés pour des adultes ;
- Des sensibilités différentes, notamment selon les tranches d’âges, etc.
Cependant, les dangers qui en découlent sont d’autant plus à prévoir compte tenu de la non-qualité et de la dangerosité des conditionnements. (8).
Bibliographie :
- C. TOULISSE, THÈSE : Développement d’une forme pharmaceutique pédiatrique administrée par voies orale ou buccale : Réglementation et importance de la palatabilité Faculté de pharmacie de université de limoges Année 2015 .
- European Medicines Agency “European Medicines Agency recommends contraindications for suppositories containing terpenic derivatives” 23 September 2011: 2 pages.
- COMMITTEE ON DRUGS. « “Inactive” Ingredients in Pharmaceutical Products: Update. » Pediatrics. 1997. Vol. 99, n°2, p. 268278.
- COMMITTEE FOR MEDICINAL PRODUCTS FOR HUMAN USE. Reflection paper: formulations of choice for the paediatric population. Londres : [s.n.], 2006.
- Prescrire Rédaction “Bronchospasmes dus aux médicaments” Rev Prescrire 2002 ; 22 (234) : 829.
- Prescrire Rédaction “Gare à l’amiodarone en pédiatrie” Rev Prescrire 2001 ; 21 (221) : 674.
- La revue prescrire. Juillet 2017/Tome 37 N° 405.
- La revue prescrire. Juin 2012/Tome 32.N° 344.3.
- https://pharmacie.hug-ge.ch/ens/mas/diplome_idg.pdf S écurité d’administration et de préparation des médicaments en. pédiatrie
- https://eurekasanté.vidal.fr
- https://web physique.fr/les excipients/
Annexes
Excipients à effet notoire ( Adulte et enfant) :
En 2003, la Commission européenne a listé 46 excipients classés à effet notoire, recommandant de faire figurer certaines mentions, mais rarement les quantités, dans l’information destinée aux patients et aux soignants. Selon l’Agence européenne du médicament elle-même, cette liste est insuffisante et incomplète. Mais malgré une réévaluation des dossiers de 14 excipients “à effet notoire”, début 2017, les recommandations sont encore inchangées. (7)
La liste des excipients à effet notoire(8)
- Aprotinine
- Huile d’arachide
- Aspartame (E951)
- Colorants azoïques
- Baume du Pérou
- Chlorure de benzalkonium
- Acide benzoïque et benzoates
- Alcool benzylique
- Huile de bergamote bergaptène
- Bronopol
- Hydroxyanisole butyle (E320)
- Hydroxytoluène butyle (E321)
- Huile de ricin polyoxyl et huile de ricin polyoxyl hydrogénée
- Alcool cétostéarylique
- Chlorocrésol
- Diméthyle sulfoxyde
- Ethanol
- Formaldéhyde
- Fructose
- Galactose
- Glucose
- Glycérol
- Héparine
- Sirop de glucose hydrogéné (ou maltitol liquide)
- Sucre inverti
- Lactitol, E966
- Lactose
- Lanoline (graisse de laine)
- Latex caoutchouc naturel
- Maltitol E965 et isomaltitol E953, maltitol liquide – mannitol, E421
- Composéss organomercuriels
- Parahydroxybenzoates et leurs esters
- Phénylalanine
- Potassium
- Propylène glycol et esters
- Huile de sésame
- Sodium
- Acide sorbique et sels
- Sorbitol E420
- Huile de soja (et huile de soja hydrogénée)
- Alcool stéarylique
- Saccharose
- Sulfites, y compris métabisulfites
- Amidon de blé – graisse de laine : voir lanoline
- Xylit
Exemples des excipients à effet notoire et leurs effets indésirables (9)
| Excipient | Contre-indications et effets indésirables |
|---|---|
| Acide borique et sels | Contre-indiqué chez les enfants de moins de 3 ans |
| Acide benzoïque et benzoate | Irritations de la peau, des muqueuses et des yeux (application locale), risque de jaunisse chez le nouveau-né (injections) |
| Acide sorbique et sels | Urticaire (application locale) |
| Alcool benzylique | Contre-indiqué chez les enfants de moins de 3 ans |
| Amidon de blé | Réactions allergiques chez les personnes allergiques au blé ou intolérantes au gluten (maladie cœliaque) |
| Aspartam | Contre-indiqué chez les personnes souffrant de phénylcétonurie |
| Broponol | Eczéma (application locale), troubles digestifs et diarrhées (voie orale) |
| Broponol | Eczéma (application locale), troubles digestifs et diarrhées (voie orale) |
| Butylhydroxyanisole | Eczéma, irritation de la peau, des muqueuses ou des yeux (application locale) |
| Butylhydroxytoluène | Eczéma, irritation de la peau, des muqueuses ou des yeux (application locale) |
| Chlorure de benzalkonium | Irritation, eczéma, difficultés à respirer ; lentilles de contact endommagées |
| Composés organomercuriels | Irritation de la peau, eczéma, troubles oculaires |
| Éthanol (alcool) | Toxicité de l’alcool. Contre-indiqué chez les femmes enceintes, les enfants de moins de 12 ans, les personnes alcooliques ou épileptiques, les personnes atteintes de maladies du foie. Attention lors de conduite de véhicule ou d’utilisation de machines. Irritation de la peau (application locale) |
| Formaldéhyde | Eczéma (application locale), troubles digestifs (voie orale) |
| Fructose | Troubles digestifs (en cas d’intolérance). Apport calorique |
| Galactose | Troubles digestifs (en cas d’intolérance). Apport calorique Contre-indiqué chez les personnes souffrant de galactosémie |
| Glucose | Troubles digestifs (en cas d’intolérance). Apport calorique |
| Glycérol | Troubles digestifs |
| Huile d’arachide | Réactions allergiques Déconseillée chez l’enfant de moins de 3 ans |
| Huile de ricin et dérivés | Troubles digestifs Eczéma (application locale) Bouffée de chaleur, difficultés à respirer, chute de tension (injections) Déconseillée chez l’enfant de moins de 3 ans |
| Huile de soja et dérivés | Réactions allergiques |
| Huile de sésame | Réactions allergiques |
| Lactose | Troubles digestifs (en cas d’intolérance). Apport calorique |
| Lanoline (graisse de laine) | Eczéma |
| Maltitol (sirop de) | Voir Fructose |
| Mannitol | Troubles digestifs |
| Paraformaldéhyde | Eczéma (application locale), troubles digestifs (voie orale) |
| Parahydroxy benzoates et leurs sels | Irritation de la peau, urticaire, difficultés à respirer |
| Polyéthylène glycol (Macrogol) | Troubles digestifs |
| Phénylalanine | Contre-indiqué chez les personnes souffrant de phénylcétonurie |
| Potassium | Douleur au point d’injection, phlébite Risque de complication lors d’insuffisance rénale Apport de potassium à prendre en considération chez les personnes qui suivent un régime pauvre en potassium |
| Propylèneglycol, sels et esters | Eczéma |
| Saccharose | Voir Fructose et Glucose |
| Sodium | Apport de sodium à prendre en considération chez les personnes qui suivent un régime pauvre en sodium |
| Sucre inverti | Voir Fructose et Glucose |
| Sulfites (métabisulfites) | Réactions allergiques |
| Tartrazine et colorants azoïques | Réactions allergiques |
| Xylitol | Troubles digestifs |
Dernière Mise à jour : juin 2018
La prégabaline, un antiépileptique de dernière génération utilisé dans le traitement de la douleur neuropathique périphérique et centrale, du trouble anxieux généralisé et de l’épilepsie partielle avec ou sans généralisation secondaire (1,2).
Conformément aux recommandations du résumé des caractéristiques (RCP) de la prégabaline, son utilisation est déconseillée tout au long de la grossesse et chez les femmes en âge de procréer sans contraception efficace (1).
Une étude observationnelle portant sur plus de 2700 grossesses exposées à la prégabaline au cours du premier trimestre réalisée dans 4 pays du Nord de l’Europe (Danemark, Finlande, Suède et Norvège), a révélé un risque de malformations congénitales majeures plus élevé (plus de 1,5 fois) par rapport à la population non exposée et à la population exposée à d’autres antiépileptiques (la lamotrigine ou la duloxétine). Le risque de malformation concerne de manière plus importante le système nerveux, l’œil, le visage (fentes oro-faciales), le système urinaire et les organes génitaux (3).
Au cours des deuxième et troisième trimestres de la grossesse, les effets à court terme de l’exposition de l’enfant à naitre sont : prématurité, petit poids de naissance, signes d’imprégnation, syndrome de sevrage et hospitalisation en soins intensifs (4).
A long terme, après exposition in utéro à la prégabaline, les troubles mentaux et du comportement sont plus fréquents que chez les enfants non exposés (4).
Au regard de ces nouvelles données et suite aux conclusions du Comité d’évaluation des risques en pharmacovigilance (PRAC) de l’Agence européenne des médicaments (EMA), l’information relative au risque de malformations congénitales majeures est en cours de mise à jour dans le résumé des caractéristiques du produit (RCP) et la notice patient (5).
Des recommandations de bon usage de ce médicament ont été émises à l’intention des professionnels de santé à savoir (3) :
- Ne prescrivez pas de prégabaline chez une patiente enceinte, sauf si le bénéfice pour la mère l’emporte clairement sur les risques potentiels pour l’enfant à naitre.
- Prenez en compte le risque malformatif dans toute prescription de prégabaline chez les femmes en âge de procréer.
- En cas de prescription de prégabaline chez une femme en âge de procréer, assurez l’utilisation d’une méthode de contraception efficace.
- Informez les patientes traitées par prégabaline du risque malformatif et de l’importance d’échanger avec vous en cas de projet de grossesse pour adapter le cas échéant le traitement.
En pratique, les patientes doivent être clairement informées des risques malformatifs associés à la prise de ce médicament et des recommandations à suivre à savoir (3):
- Utilisez une contraception efficace.
- Consultez le médecin traitant en cas de désir de grossesse pour adapter le traitement à ce projet.
- Consultez rapidement le médecin en cas de grossesse ou projet de grossesse pour qu’il :
- Evalue la nécessité de poursuivre le traitement par prégabaline en cas d’épilepsie;
- Procède à l’arrêt du traitement et à l’adaptation de la prise en charge en cas de trouble anxieux généralisé ou des douleurs neuropathiques.
Conclusion :
Le risque de malformation chez les enfants exposés pendant la grossesse à la prégabaline est aujourd’hui confirmé et conforte la nécessité de ne pas utiliser ce médicament pendant la grossesse sauf en l’absence d’alternative thérapeutique. L’information des patientes et des professionnels de santé de ce risque est capitale afin de suivre les recommandations nécessaires pour éviter sa survenue.
Bibliographie :
- ANSM ″RCP-Prégabaline″. Mise à jour le 24 Janvier 2019 : 11 pages.
- ″Prégabaline″.https://pharmacomedicale.org/. Mise à jour le 31 Mai 2017 : 04 pages.
- ANSM ″Le risque de malformation chez les enfants exposés pendant la grossesse à la prégabaline est confirmé″. Mise à jour le 08 Juillet 2022 : 02 pages.
- ″Prégabaline ou gabapentine pendant la grossesse : dangers avérés et incertitudes à prendre en compte″. Rev prescrire 2020 ; 40 (436) : 112-114. 5- ANSM ″ Topiramate, prégabaline et valproate : publication de nouvelles données sur les risques liés à l’exposition à ces médicaments″. Mise à jour le 08 Juillet 2022 : 02 pages.
Dernière mise à jour : Septembre 2022
Le valproate et ses dérivés sont formellement contre-indiqués pendant la grossesse, sauf en l’absence d’alternative thérapeutique (1).
Dans le cadre de l’évaluation continue au niveau européen des médicaments contenant du valproate et ses dérivés, de nouvelles données sur les risques liés à leur utilisation, en particulier pendant la grossesse, ont été rendues disponibles à savoir (2,3):
- Evolution du pourcentage du risque de malformations congénitales majeures estimées à environ 11%.
- Ajout du risque de malformations congénitales oculaires.
- Risques liés à une polythérapie antiépileptique contenant du valproate.
- Ajout du risque d’atteinte de la fertilité masculine notamment la diminution de la mobilité des spermatozoïdes. Ces effets sont généralement réversibles après 3 mois d’arrêt du traitement et possiblement réversibles après diminution de la dose.
Conclusion:
Il est important de renforcer l’information des professionnels de santé ainsi que des patients sur ces nouvelles données portant sur les risques liés à l’exposition à ces spécialités à base de valproate pendant la grossesse et sur la fertilité masculine pour minimiser et bien gérer ces risques.
Bibliographie :
- ANSM ″RCP-Valproate de sodium″. Mise à jour le 05 Mai 2020 : 15 pages.
- ANSM ″ Topiramate, prégabaline et valproate : publication de nouvelles données sur les risques liés à l’exposition à ces médicaments″. Mise à jour le 08 Juillet 2022 : 02 pages.
- ANSM ″Valproate et dérivés : mise à jour des informations sur le risque″. Mise à jour le 08 Juillet 2022 : 01 page.
Dernière mise à jour : Août 2022
L’hydroxyzine est commercialisé dans le traitement des troubles anxieux, le soulagement du prurit, la prémédication avant une intervention chirurgicale et le traitement des troubles du sommeil (1).
Le risque d’allongement de l’intervalle QT est bien connu avec les spécialités à base d’hydroxyzine qui sont déjà contre-indiquées chez les patients présentant un allongement acquis ou congénital de l’intervalle QT (1,2).
Les facteurs de risque de survenue d’un allongement de l’intervalle QT suite à l’utilisation de l’hydroxyzine sont (2,3) :
- La pathologie cardiovasculaire ;
- Les antécédents familiaux de mort subite d’origine cardiaque ;
- Les troubles électrolytiques significatifs comme une hypokaliémie ou une hypomagnésémie ;
- La bradycardie significative et traitement concomitant par un médicament connu pour allonger l’intervalle QT et/ou susceptibles d’induire des torsades de pointes.
De nouvelles restrictions pour minimiser le risque connu d’allongement de l’intervalle QT avec les spécialités à base d’hydroxyzine ont été mises en place à savoir (3):
- La dose maximale journalière est de :
- 100 mg /jour chez l’adulte et chez l’enfant de plus de 40 kg,
- 2 mg / kg / jour chez l’enfant jusqu’à 40 kg.
- Le traitement par l’hydroxyzine doit être pris à la dose minimale efficace et pendant la durée de traitement la plus courte possible.
- L’hydroxyzine n’est pas recommandée chez les sujets âgés : si toutefois une prescription s’avère nécessaire, la dose maximale journalière doit être de 50 mg/j.
- L’hydroxyzine est contre-indiquée chez les patients présentant un allongement acquis ou congénital connu de l’intervalle QT et chez les patients présentant un facteur de risque connu d’allongement de l’intervalle QT.
- L’utilisation de l’hydroxyzine avec des médicaments susceptibles d’induire une bradycardie ou une hypokaliémie doit faire l’objet d’une précaution d’emploi.
En pratique, le respect des mesures de minimisation des risques cardiaques connus liés aux médicaments contenant l’hydroxyzine est primordial pour éviter les effets indésirables évitables.
Bibliographie :
- ʺLe PRAC recommande des nouvelles mesures pour minimiser les risques cardiaques connus liés aux médicaments contenant l’hydroxysineʺ. https://www.ema.europa.eu/en/news/prac-recommends-new-measures-minimise-known-heart-risks-hydroxyzine-containing-medicines: 01 page. Consulté le 30/07/2019.
- Hydroxyzine (Atarax et génériques) : nouvelles restrictions d’utilisation pour minimiser le risque d’allongement [QT] – Point d’Informationʺ. www.ansm.santé.fr: 02 pages. Consulté le 30/07/2019.
- ʺRéévaluation des médicaments à base d’hydroxyzine et des médicaments à base de codéine utilisés chez l’enfant, retour d’information sur le PRAC de février 2015 – Point d’informationʺ. www.ansm.santé.fr: 02 pages. Consulté le 30/07/2019.
Dernière mise à jour : Août 2019
Le paracétamol, médicament le plus couramment prescrit et utilisé comme antalgique ou antipyrétique chez les adultes et les enfants. Il est présent dans de nombreux médicaments, seul ou associé à d’autres substances actives (1,2).
Le paracétamol peut en effet être la cause de graves lésions hépatiques parfois irréversibles survenant le plus souvent en cas de surdosage par le non respect de la posologie ou en l’associant avec plusieurs produits contenant du paracétamol. Néanmoins, l’hépatotoxicité à doses thérapeutiques peut survenir chez le jeune, dans le cas de la malnutrition ; la consommation d’alcool chronique ou excessive et certaines variabilités interindividuelles et interethniques (1).
La mauvaise utilisation du paracétamol expose à des atteintes hépatiques aiguës graves conduisant parfois à une greffe hépatique. En France, une étude a montré que le paracétamol est le médicament le plus impliqué dans les greffes hépatiques d’origine médicamenteuse (3).
En cas d’intoxication massive et volontaire, des nausées et des vomissements apparaissent dans les 12 heures suivant l’ingestion. Deux à trois jours après, les enzymes hépatiques augmentent de même que la bilirubine et des troubles de la coagulation apparaissent. Dans les cas les plus sévères, des saignements importants, un coma puis le décès peuvent survenir (4).
Une étude écossaise réalisée chez 663 patients hospitalisés entre 1992 et 2008 dans une unité de transplantation hépatique, pour hépatotoxicité sévère liée au paracétamol. 74 % de ces patients avaient ingéré une seule dose massive de paracétamol (dans 98 % des cas dans un but de suicide) alors que 26 % des patients étaient en situation de surdosages répétés mais modérés (dont 34 % d’entre eux dans un but suicidaire). Environ 83 % des patients en surdosages modérés mais répétés de paracétamol prenaient ce médicament pour soulager leurs douleurs. Ces surdosages semblent survenir lors d’une automédication pour une douleur, favorisée par la prise d’autres antalgiques associant paracétamol et antalgiques opioïdes faibles (codéine, dextropropoxyphène, tramadol) (4).
Les auteurs ont constaté que ces surdosages réguliers, même modérés, c’est-à-dire juste au-dessus de 4 g par jour de paracétamol, étaient d’autant plus dangereux que les personnes étaient âgées, éthyliques, dénutries. Les auteurs concluent même que ces surdosages modérés itératifs sont plus dangereux qu’une prise massive unique (4).
A priori, dans des conditions normales d’utilisation chez des patients n’ayant pas de pathologie hépatique sous jacente, l’hépatotoxicité du paracétamol est tout à fait exceptionnelle (4).
Le respect des recommandations de bon usage est primordial pour éviter l’hépatotoxicité à savoir (1,2):
-Utiliser la dose la plus faible, le moins longtemps possible.
-Respecter la dose maximale quotidienne (4g/j) et la durée de traitement recommandée ;
-Vérifier la présence de paracétamol dans les autres médicaments ;
-A éviter chez les patients à risques : insuffisance hépatique légère à modérée, insuffisance rénale sévère, alcoolisme chronique, moins de 50 kg, etc.
Un message d’alerte sur les boites du paracétamol est important pour réduire le risque de surdosage et donc d’atteinte hépatique (1,3).
En pratique, l’information des patients du risque de toxicité hépatique suite à l’utilisation du paracétamol et la diffusion des mesures de la bonne utilisation sont primordiales afin d’éviter les effets indésirables évitables.
Bibliographie :
- ʺParacétamol et risque pour le foie : un message d’alerte ajouté sur les boîtes de médicamentʺ.www.ansm.santé.fr : 02 pages. Consulté le 22/07/2019.
- ʺParacétamol : des risques trop peu connus des patientsʺ Rev Prescrire 2019 ; 39 (427) : 382-383.
- ʺRéponse Prescrire consultation ANSM-Mention d’alerte sur les boites du paracétamolʺ. https://www.prescrire.org/Docu/DOCSEUROPE/20180928_PrescrireReponseConsultationMentionDangerSurdoseParacetamol.pdf: 09 pages. Consulté le 22/07/2019.
- ʺLe paracétamol est-il vraiment peu efficace et dangereux?ʺ. https://www.sfetd-douleur.org/sites/default/files/u3349/DossierdumoisSFETD/2015/dossierdumois150415leparacetamolest-ildangereuxvd.pdf: 10 pages. Consulté le 21/07/2019.
Dernière mise à jour : Août 2019
La dompéridone est indiquée pour le traitement des nausées et des vomissements uniquement chez les adultes et les enfants de plus de 12 ans et pesant plus de 35 kg, dans les cas de gastro-entérite, infections virales, etc. La balance bénéfices-risques est défavorable chez les enfants (1).
L’autorisation de mise sur le marché (AMM) de la dompéridone a été retirée chez l’adulte et chez l’enfant pour les indications suivantes (2):
- Le reflux gastro-œsophagien ;
- La gastroparésie ;
- La dyspepsie ;
- Les nausées et les vomissements induits par radiothérapie, chimiothérapie ou agoniste dopaminergique ;
- La stimulation de la montée laiteuse.
Compte tenu du risque d’effets indésirables cardiaques graves notamment l’allongement de l’intervalle QT, les torsades de pointes, les arythmies ventriculaires graves et la mort subite d’origine cardiaque et des troubles neurologiques (1,2). La prescription de la dompéridone n’est envisagée que dans le cas de vomissements ayant à court terme des complications graves ou très gênantes (2).
Afin de réduire les risques d’effets indésirables cardiaques graves, des recommandations du bon usage de la dompéridone ont été émises à savoir :
- La dose est limitée à 10 mg jusqu’à 3 fois par jour, avec une dose maximale de 30 mg par jour chez les adultes et les enfants de plus de 12 ans et pesant plus de 35 kg (1).
- La durée de traitement doit être la plus courte possible : elle ne doit pas dépasser une semaine (1).
- L’ administration de la dompéridone est contre indiquée dans le cas de :
- L’insuffisance hépatique modérée à sévère (1).
- L’allongement connu des intervalles de conduction cardiaque, notamment de l’intervalle QT, troubles électrolytiques importants ou maladies cardiaques sous-jacentes telles qu’une insuffisance cardiaque congestive (1) ;
- La prise concomitante des inhibiteurs puissants du CYP3A4 et des médicaments prolongeant l’intervalle QT (1).
En pratique, le respect des mesures de minimisation des risques cardiaques liés à la prescription des médicaments à base de dompéridone est indispensable afin d’éviter les effets indésirables évitables.
Bibliographie :
- ʺLa dompéridone (Motilium et génériques) ne doit plus être utilisée chez l’enfant de moins de 12 ans – Point d’informationʺ.www.ansm.santé.fr. 02pages. Consulté le 07/07/2019.
- ʺMédicaments antiémétiques dans le traitement symptomatique des nausées et vomissementsʺ. https://www.has-sante.fr/jcms/c_2966830/fr/medicaments-antiemetiques-dans-le-traitement-symptomatique-des-nausees-et-vomissements. 05 pages. Consulté le 07/007/2019
Dernière mise à jour : Juillet 2019
Le nifuroxazide (Ercefuryl et ses génériques), un antiseptique intestinal indiqué dans le traitement de la diarrhée aiguë présumée d’origine bactérienne en l’absence de suspicion de phénomènes invasifs (altération de l’état général, fièvre, signes toxi-infectieux…).
Le nifuroxazide a fait l’objet d’un mésusage important et des effets indésirables graves ont été recensés, notamment des effets d’ordre :
- Immuno-allergique : des réactions d’hypersensibilité immédiate (choc anaphylactique, œdème de Quincke), survenant notamment chez l’enfant et susceptibles de mettre en jeu le pronostic vital.
- Photosensibilité (soleil, rayon UV) et autres atteintes cutanées.
- Effets indésirables hématologiques : diminution du nombre de plaquettes, de globules rouges, et globules blancs.
En raison des risques liés au nifuroxazide, essentiellement d’ordre immuno-allergique, et d’un mésusage important, cet anti-infectieux intestinal est désormais délivré uniquement sur prescription médicale, et ne plus être utilisé chez l’enfant et l’adolescent de moins de 18 ans.
Des recommandations ont été émises à tous les laboratoires fabriquants à savoir:
- La mise à jour du Résumé des Caractéristiques du Produit et la notice
- L’étiquetage des spécialités concernées à savoir une étiquette devra être apposée sur les boites afin d’avertir les professionnels de santé et les patients de la mise en place de ces nouvelles mesures.
- Rajouter la contre indication chez l’enfant et l’adolescent de moins de 18 ans.
Il est important de rappeler que, dans la majorité des cas, les diarrhées guérissent sans traitement médicamenteux. La prise en charge chez le petit enfant repose essentiellement sur l’administration de solutés de réhydratation orale.
Dernière mise à jour : Août 2019
Abstract
Les produits de contraste iodés hydrosolubles actuellement utilisés contiennent une concentration d’iodures libres inférieure à 50 μg/ml au moment de leur fabrication.
Cette concentration peut augmenter avec la durée de stockage du produit de contraste (1).
La quantité d’iodures reçue lors d’une injection de produit de contraste peut représenter jusqu’à 50 fois l’apport journalier recommandé qui est de 150 μg par jour.
Suite à l’administration de ces produits de contraste iodés, des anomalies de synthèse et de libération des hormones thyroïdiennes peuvent survenir (hypothyroidie ou hyperthyroidie).
I. Rappel physiologique :
En présence de quantités croissantes d’iode, la production thyroïdienne s’accroît jusqu’à un maximum, puis se réduit du fait d’un blocage de l’organification des iodures (effet Wolff-Chaikoff), et réaugmente après quelques jours par échappement (2, 3).
A. Hypothyroïdie suite à l’administration d’un produit de contraste iodé :
Chez certains individus, tout particulièrement en cas d’anomalie mineure de la biosynthèse hormonale ou de thyroïdite auto-immune, il n’y a pas d’échappement au blocage de l’organification.
Survient alors une hypothyroïdie, parfois discrète (augmentation isolée de TSH), parfois plus franche (baisse de T4 libre (T4L), augmentation de TSH) de durée variable (4).
B. Hyperthyroïdie suite à l’administration d’un produit de contraste iodé :
A l’inverse, l’excès d’iodures peut déterminer une hyperthyroïdie : Soit fonctionnelle lorsque le parenchyme thyroïdien est remanié par des nodules fonctionnels dont l’activité augmente du fait de la disponibilité accrue en iode.
Soit toxique sur glande saine ou pathologique, où l’excès d’iode est susceptible de déterminer une dilacération de la structure vésiculaire, libérant le contenu hormonal dans la circulation (thyroïdite iodée) (5).
II. Aspect Clinique :
1. Enfant et nouveau-né :
Dans cette population, l’administration d’un produit de contraste iodé risque de causer surtout une hypothyroïdie.
Les conséquences de la carence hormonale sont particulièrement délétères chez le nouveau-né et le nourrisson, puisque les hormones thyroïdiennes sont fortement impliquées dans le développement statural et intellectuel.
- Nouveau-né prématuré (avant 37 semaines d’aménorrhée) le risque d’une hypothyroïdie est particulièrement élevé, surtout si le prématuré est de petit poids (6,7), même après une dose minime (0,3 ml de produit de contraste iodé) (8).
- Nouveau-né dont la mère a reçu une injection de produit de contraste iodé pendant la grossesse (9). Le dépistage néonatal systématique permet d’identifier les éventuelles hypothyroïdies.
- Nourrisson (29 jours à 2 ans) souffrant d’un syndrome polymalformatif congénital chez qui l’injection d’une quantité importante de produit de contraste iodé pour l’exploration d’une cardiopathie risque de déséquilibrer un métabolisme thyroïdien précaire (10).
2. Adulte :
L’utilisation d’un produit de contraste iodé risque de causer une hypothyroïdie ou une hyperthyroïdie.
Adultes à risque d’hyperthyroïdie :
- Hyperthyroïdie actuelle, non traitée.
- Antécédent d’hyperthyroïdie (notamment par maladie de Basedow).
- Goitre multinodulaire, en particulier dans les situations de carence iodée, chez les sujets âgés (11).
L’hyperthyroïdie favorise la survenue de troubles du rythme cardiaque ou d’incidents coronariens.
Adultes à risque d’hypothyroïdie :
- Sujets atteints de thyropathie auto-immune, non substitués par l’hormone thyroïdienne.
III. Recommandations et conduite pratique :
Enfants :
Chez le nouveau-né prématuré ou de petit poids, l’injection de produit de contraste iodé doit être discutée, et un examen d’imagerie alternatif peut être proposé.
Si l’indication d’injection est maintenue, il est recommandé d’utiliser la dose efficace la plus faible possible, puis de contrôler la fonction thyroïdienne la semaine suivante.
Le dosage à réaliser est celui de la thyrotropine (TSH) complété seulement en cas d’anomalie par celui de la thyroxine libre (T4L). Il conviendra de traiter l’hypothyroïdie persistante.
En unité de néonatalogie ou de réanimation, il est préférable de recourir à l’utilisation de cathéter radio-opaque afin d’éviter l’injection de produit de contraste iodé pour contrôler la position du cathéter (6, 7, 8).
Adultes :
Patient devant bénéficier prochainement d’une scintigraphie thyroïdienne ou d’un traitement par l’iode radio-actif :
- Commencer par la scintigraphie ou l’injection thérapeutique d’iode radioactif avant l’injection de produit de contraste iodé au scanner.
- A défaut, retarder la scintigraphie ou l’injection thérapeutique d’iode radioactif d’au moins deux mois après le scanner avec injection de produit de contraste iodé (1).
Patient hypothyroïdien sous traitement substitutif : l’injection de produit de contraste iodé n’entraîne pas de problème particulier.
Contre-indication à l’administration d’un produit de contraste iodé :
- Contre-indication absolue à l’administration de produit de contraste iodé :
Hyperthyroïdie non traitée ou non équilibrée (risque d’aggravation). En situation d’urgence, recourir à un autre procédé d’investigation.
- Contre-indications relatives et précautions d’emploi :
Chez les patients présentant une thyroïdite auto-immune, un goitre nodulaire, un antécédent de maladie de Basedow ou d’hyperthyroïdie liée à une surcharge iodée, l’administration d’un agent de contraste radiographique iodé est susceptible d’induire soit une hypothyroïdie, soit une hyperthyroïdie.
Celles-ci sont ordinairement, mais non nécessairement transitoires, et s’avèrent particulièrement délétères chez les sujets âgés ou cardiaques.
Dès lors chez ces patients, l’intérêt de l’opacification doit être discuté (l’IRM avec injection de produit gadoliné constitue une alternative possible).
Si l’indication est maintenue, l’état de la fonction thyroïdienne est à évaluer avant, puis à contrôler par exemple entre 3 jours et une semaine et au-delà si surviennent des signes cliniques d’hypo- ou d’hyperthyroïdie.
La mesure de la TSH est suffisante, complétée par celle de T4L seulement en cas d’anomalie de la TSH.
Il n’existe pas de contre-indication à l’utilisation d’un agent de contraste iodé lorsque le sujet hyperthyroïdien est traité par un antithyroïdien qui bloque le
cycle d’utilisation de l’iode.
Aucune préparation ou surveillance particulière n’est alors à envisager.
Lorsque le risque d’hyperthyroïdie est majeur chez un sujet fragile (âgé, cardiaque…), l’endocrinologue peut prescrire du perchlorate de potassium
(KClO4 1g par jour par voie orale), pour bloquer préventivement la pénétration intrathyroïdienne de l’iode.
Il pourra aussi avoir recours à un antithyroïdien de synthèse (12, 13).
References Bibliographiques :
- Van der Molen AJ, Thomsen HS, Morcos SK; “Effect of iodinated contrast media on thyroid function in adults”. Eur Radiol 2004 ; 14 : 902-7
- Wolff J, Chaikoff IL. “The inhibitory action of excessive iodide upon the synthesis of diiodotyrosine and of tyrosine in the thyroid gland of the normal rat”. Endocrinology 1948 ; 43 : 174-9
- Aurengo A, Leenhardt L, Aurengo H. « Adaptation de la fonction thyroïdienne à la surcharge iodée ». Presse Med 2002 ; 31 : 1658-63
- Wémeau JL. « Hypothyroïdies liées aux surcharges iodées ». Presse Med 2002 ; 31 : 1670-5
- Thomopoulos P. « Hyperthyroïdies par surcharge iodée ». Presse Med 2002 ; 31 : 1664-69
- Parravicini E, Fontana C, Paterlini GL, Tagliabue P, Rovelli F, Leung K, Stark RI. «Iodine, thyroid function, and very low birth weight infants”. Pediatrics 1996 ; 98 : 730-4
- L’Allemand D, Gruters A, Beyer P, Weber B. “Iodine in contrast agents and skin disinfectants is the major cause for hypothyroidism in premature infants during intensive care”. Horm Res 1987 ; 28 : 42-9
- Giroux JD, Sizun J, Gardach C, Awad H, Guillois B, Alix D. « Hypothyroïdie transitoire après opacification iodée des cathéters épicutanéocaves en réanimation néonatale ». Arch Fr Pediatr 1993 ; 50 : 585-8
- Webb JA, Thomsen HS, Morcos SK; Contrast Media Safety Committee, European Society of UrogenitalRadiology (ESUR). “The use of iodinated and gadolinium contrast media during pregnancy and lactation”. Eur Radiol 2005 ; 15 : 1234-40
- Del Cerro Marin M, Fernandez Ruiz A, Garcia-Guereta L, Benito Bartolome F, Burgueros M, Ares Segura S,Moreno F, Gracia Bouthelier R. “Thyroid function alterations in children with congenital cardiac disease after catheterization with iodinated contrast agents”. Rev Esp Cardiol 2000 ; 53 : 517-24
- Martin FI, Tress BW, Colman PG, Deam DR. “Iodine-induced hyperthyroidism due to nonionic contrast radiography in the elderly”. Am J Med 1993 ; 95 : 78-82
- Nolte W, Muller R, Siggelkow H, Emrich D, Hubner M. “Prophylactic application of thyrostatic drugs during excessive iodine exposure in euthyroid patients with thyroid autonomy : a randomized study”. Euro J Endocrinol 1996 ; 134, 337-41
- Wémeau JL., Bauters C, Gérard Y, Deligne A, Coviaux R, Lion G, Steinling M, Decoulx M.« Le perchlorate de potassium dans l’exploration et le traitement des maladiesthyroïdiennes ». La Rev. Fr d’Endocrino Clin. 1991; 32, 499-507
Télécharger ce document [PDF – 159 KO]
Dernière Mise à jour : Mars 2017
Recommandations de l’OMS concernant les soins anténatals pour que la grossesse soit une expérience positive
Les soins anténatals constituent une plateforme pour fournir d’importantes prestations de santé, dont la promotion de la santé, le dépistage et le diagnostic, et la prévention des maladies. Il est aussi établi que, grâce à la mise en œuvre en temps utile de pratiques appropriées fondées sur les preuves, les soins anténatals peuvent sauver des vies.
Point également déterminant : ces soins offrent l’opportunité de communiquer avec les femmes enceintes, les familles et les communautés, et de les soutenir, à un moment critique de la vie de ces femmes.
Le processus d’élaboration de ces recommandations concernant les soins anténatals a mis en lumière l’importance d’une communication efficace sur les questions physiologiques, biomédicales, comportementales et socioculturelles et d’un soutien efficient, notamment sur le plan social, culturel, affectif et psychologique, à l’intention des femmes enceintes.
Ce sont un ensemble de recommandations exhaustives de l’OMS sur les soins anténatals systématiques à l’intention des femmes enceintes, pour compléter les lignes directrices de l’OMS existantes sur la prise en charge des complications spécifiques associées à la grossesse.
L’élaboration de ces recommandations s’est appuyée sur une analyse systématique de la perception des femmes, qui montre que celles-ci veulent faire de leur grossesse une expérience positive à travers les soins anténatals.
Reconnaissant que la façon dont les femmes vivent les soins est essentielle pour transformer les soins anténatals et favoriser la prospérité des familles et des communautés, ces recommandations s’efforcent de répondre aux questions suivantes :
- Quelles pratiques fondées sur les preuves et mises en œuvre pendant les soins anténatals pourraient améliorer les issues de la grossesse et déboucher sur une expérience positive pour cette phase de la vie ?
- Comment délivrer ces pratiques ?
Ces interventions sont soit recommandées, non recommandées ou recommandées dans certaines conditions.
| A. Intervention nutritionnelles | Recommandation |
|---|---|
| Interventions diététiques | Des conseils en faveur d’une alimentation saine et du maintien d’une activité physique pendant la grossesse sont recommandés pour les femmes enceintes afin qu’elles restent en bonne santé et n’enregistrent pas un gain de poids excessif. *Suppléments de fer et d’acide folique, *Suppléments de calcium, *Suppléments de Vitamine A, *Suppléments de zinc, *Suppléments de micronutriments multiples, *Suppléments de vitamine B6, *Suppléments de vitamines E et C, *Suppléments de vitamine D, Restriction de la prise de caféine. |
| Acide benzoïque et benzoate | Recommandation |
| B.1 : Évaluation maternelle | |
| Anémie | Contre-indiqué chez les enfants de moins de 3 ans |
| Bactériurie asymptomatique (BA) | La mise en culture de l’urine du milieu du jet est la méthode recommandée pour diagnostiquer une bactériurie asymptomatique (BA) pendant la grossesse. Dans les contextes où cette méthode n’est pas disponible, une coloration de Gram sur place de l’urine du milieu du jet est recommandée de préférence à l’utilisation de bandelettes réactives pour diagnostiquer cette maladie chez les femmes enceintes. |
| Violence du partenaire sexuel (VPS) | Lors des visites anténatales. |
| Recommandations intégrées à partir d’autres lignes directrices de l’OMS et intéressant le soin anténatal « Évaluation maternelle » | |
| Diabète gestationnel (DG) | Une hyperglycémie détectée pour la première fois à un moment quelconque de la grossesse devra être classée comme un diabète gestationnel (DG) ou un diabète pendant la grossesse, en fonction des critères de l’OMS. |
| Tabagisme | Les prestataires de soins devront interroger toutes les femmes enceintes sur leur consommation de tabac (passée et actuelle) et leur éventuelle exposition passive à la fumée de tabac, à un stade le plus précoce possible de la grossesse et à chaque visite pour des soins anténatals. |
| Consommation de substances | Les prestataires de soins devront interroger toutes les femmes enceintes sur leur consommation d’alcool et d’autres substances (passée et actuelle). |
| Virus de l’immunodéficience humaine (VIH) et syphilis | Eliminer la transmission mère-enfant du VIH et intégrer le dépistage de ce virus à celui de la syphilis, de maladies virales ou d’autres affections importantes, en fonction du contexte, et également pour renforcer les systèmes de santé sous-jacents de la mère et de l’enfant. |
| Tuberculose | Dans les contextes où la prévalence de la tuberculose dans la population générale atteint 100/100 000 habitants ou plus, le dépistage systématique de la tuberculose évolutive chez la femme enceinte devra être considéré comme faisant partie des soins anténatals. |
| B.2 : Évaluation du fœtus | |
| Décompte quotidien des mouvements du fœtus | Le décompte quotidien des mouvements fœtaux, par exemple en relevant sur un diagramme le nombre de coups de pied, n’est recommandé que dans le contexte de recherches menées de manière rigoureuse. |
| Mesure de la hauteur de l’utérus depuis la symphyse pubienne | Le remplacement de la palpation abdominale par la mesure de la hauteur de l’utérus depuis la symphyse pubienne pour l’évaluation de la croissance fœtale n’est pas recommandé pour améliorer les issues périnatales de la grossesse. |
| Cardiotocographie anténatale | La cardiotocographie anténatale systématique n’est pas recommandée chez les femmes enceintes dans le but d’améliorer les issues maternelles et périnatales de la grossesse. |
| Échographie | Une échographie avant 24 semaines de grossesse (échographie précoce) est recommandée pour les femmes enceintes afin d’estimer l’âge gestationnel, d’améliorer la détection des anomalies fœtales et des grossesses multiples, de réduire l’induction du travail pour les grossesses ayant dépassé le terme et d’améliorer le vécu de la grossesse par les femmes. |
| Échographie Doppler des vaisseaux sanguins fœtaux | L’examen par échographie Doppler systématique n’est pas recommandé chez les femmes enceintes dans le but d’améliorer les issues maternelles et périnatales de la grossesse. |
| C. Mesures préventives | Recommandation |
| Antibiotiques contre la bactériurie asymptomatique (BA) | Une cure d’antibiotiques de sept jours est recommandée chez toutes les femmes enceintes atteintes de bactériurie asymptomatique (BA) pour prévenir une bactériurie persistante, une naissance avant terme et un petit poids de naissance. |
| Prophylaxie antibiotique pour prévenir les infections urinaires récurrentes | Une prophylaxie antibiotique n’est recommandée pour prévenir les infections récurrentes des voies urinaires chez les femmes enceintes que dans un contexte de recherche menée de manière rigoureuse |
| Administration anténatale d’immunoglobuline anti-D | Une prophylaxie anténatale avec de l’immunoglobuline anti-D à 28 et 34 semaines de grossesse chez les femmes enceintes Rhésus négatif non sensibilisées, dans le but de prévenir une allo immunisation RhD, n’est recommandée que dans le contexte d’une recherche menée de manière rigoureuse. |
| Traitement anti helminthique préventif | Dans les zones d’endémie, un traitement anthelminthique préventif est recommandé chez les femmes enceintes après le premier trimestre de grossesse dans le cadre des programmes de lutte contre les vers. |
| Vaccination par l’anatoxine tétanique | La vaccination par l’anatoxine tétanique est recommandée chez toutes les femmes enceintes, en fonction de leur exposition antérieure à la vaccination antitétanique, en vue de prévenir la mortalité néonatale due au tétanos. |
| Recommandations intégrées à partir d’autres lignes directrices de l’OMS et pertinentes pour les soins anténatals | |
| Prévention du paludisme: traitement préventif intermittent pendant la grossesse (TPI) | Dans les zones d’endémie du paludisme situées en Afrique, un traitement préventif intermittent par la sulfadoxine-pyriméthamine (TPI-SP) est recommandé pour toutes les femmes enceintes. |
| Prophylaxie préexposition (PrPE) pour la prévention du VIH | Une prophylaxie orale préexposition (PrPE) incluant du fumarate de ténofovir disoproxil (TDF) devra être proposée en tant qu’option préventive supplémentaire aux femmes enceintes exposées à un risque substantiel d’infection à VIH dans le cadre des approches préventives combinées. |
| D. Interventions face à des symptômes physiologiques courants | Recommandation |
| Nausées et vomissements | Gingembre, camomille, vitamine B6 et/ou acupuncture sont recommandés pour soulager les nausées au début de la grossesse, en fonction des préférences de la femme et des options disponibles. |
| Brûlures d’estomac | Des conseils relatifs au régime alimentaire et au mode de vie sont recommandés pour prévenir et soulager les brûlures d’estomac pendant la grossesse. Des préparations antiacides peuvent être proposées aux femmes présentant des symptômes pénibles qui ne sont pas soulagés par une modification de leur mode de vie. |
| Crampes dans les jambes | Il est possible d’utiliser du magnésium, du calcium ou des options thérapeutiques non pharmacologiques pour soulager les crampes dans les jambes pendant la grossesse, en fonction des préférences de la femme et des options disponibles. |
| Douleurs lombaires et pelviennes | L’exercice régulier est préconisé pendant la totalité de la grossesse pour prévenir les douleurs lombaires et pelviennes. Il existe un certain nombre de solutions thérapeutiques applicables telles que la kinésithérapie, les ceintures de maintien et l’acupuncture, en fonction des préférences de la femme et des options disponibles. |
| Constipation | On peut utiliser des suppléments à base de son de blé ou d’autres fibres pour soulager la constipation pendant la grossesse si celle-ci ne répond pas aux modifications du régime alimentaire, en fonction des préférences de la femme et des options disponibles. |
| Veines variqueuses et œdèmes | Des options non pharmacologiques telles que bas et chaussettes de contention, surélévation des jambes et immersion dans l’eau peuvent être appliquées. |
| E. Interventions des systèmes de santé pour améliorer l’utilisation et la qualité des soins anténatals | Recommandation |
| Notes de consultation détenues par les femmes | Il est recommandé que chaque femme enceinte conserve avec elle les notes qui ont été prises lors des consultations pour améliorer la continuité et la qualité des soins ainsi que le vécu de sa grossesse. |
| Continuité des soins sous la direction de sages-femmes | Sous la direction de sages- femmes, soutient une femme sur l’ensemble de la période anténatale, intrapartum. |
| Soins anténatals de groupe | Des soins anténatals de groupe, dispensés par des professionnels de santé qualifiés, peuvent être proposés en tant qu’alternative aux soins anténatals individuels. |
| Interventions communautaires pour améliorer la communication et le soutien | Les groupes de femmes participatifs représentent une opportunité pour les femmes de discuter de leurs besoins pendant la grossesse, et notamment des obstacles pour parvenir jusqu’aux soins, et également d’améliorer le soutien apporté aux femmes enceintes. |
| Recrutement et rétention du personnel dans les zones rurales et reculées | Les décideurs politiques devront envisager des interventions éducatives, réglementaires, financières et sous forme de soutien personnel ou professionnel pour recruter et retenir du personnel soignant qualifié dans les zones rurales et reculées. |
| Calendriers des prises de contact pour les soins anténatals | Des modèles de soins anténatals prévoyant au moins huit contacts sont recommandés pour réduire la mortalité périnatale et améliorer le vécu des soins par les femmes. |
En somme, ce sont des recommandations aussi utiles pour les professionnels de santé, les futurs parents, ainsi que les décideurs.
Lien : http://www.who.int/reproductivehealth/publications/maternal_perinatal_health/anc-positive-pregnancy-experience/fr/ 
Dernière Mise à jour : Mars 2017
I. Indications :
Le déférasirox est indiqué dans le traitement de la surcharge en fer chronique secondaire à des transfusions sanguines lorsque:
- Elles sont fréquentes (≥7 ml/kg/mois de concentrés érythrocytaires) chez les patients de 6 ans et plus présentant une ß-thalassémie majeure.
- Le traitement par la déféroxamine est contre-indiqué ou inadapté chez les groupes de patients suivants :
- Patients présentant d’autres anémies ;
- Patients âgés de 2 ans à 5 ans ;
- Patients présentant une ß-thalassémie majeure avec une surcharge en fer chronique secondaire à des transfusions sanguines peu fréquentes (< 7 ml/kg/mois de concentrés érythrocytaires).
Le traitement a pour but d’éliminer le fer apporté par les transfusions et si nécessaire de réduire la surcharge en fer existante.
II. Mode d’utilisation:
- Le Deferox® doit être pris une fois par jour,à jeun, au moins 30 minutes avant de prendre un repas, de préférence à la même heure tous les jours.
- Les comprimés doivent être complètement dissous dans un verre d’eau, de jus d’orange ou de jus de pomme (100 ml à 200 ml). Toute quantité restante doit être remise en suspension avec un peu d’eau ou de jus de fruit puis avalée.
III. Posologie:
- Le traitement devrait être initié:
- Après une transfusion d’environ 20 unités de concentrés érythrocytaires (soit 100 ml/kg).
- Lorsque le suivi clinique met en évidence la présence d’une surcharge en fer (par exemple ferritinémie > 1000 μg/l).
- Les doses doivent être calculées en mg/kg et arrondies au dosage du comprimé le plus proche.
Dose initiale :
- La dose initiale recommandée est de 20 mg/kg/j.
- Une dose initiale de 30 mg/kg/j peut être envisagée pour les patients qui reçoivent plus de 14 ml/kg/mois de concentrés érythrocytaires.
- Une dose initiale de 10 mg/kg/j peut être envisagée pour les patients qui reçoivent moins de 7 ml/kg/mois de concentrés érythrocytaires.
- Chez les patients déjà bien équilibrés avec un traitement par la déféroxamine, une dose initiale de déférasirox (la moitié de celle de la déféroxamine) pourra être envisagée.
Si la dose journalière résultante est de moins de 20 mg/kg/j, une augmentation de la dose devra être envisagée en cas d’une réponse insuffisante.
Dose d’entretien :
- Contrôle de la ferritinémie tous les mois.
- L’ajustement de la dose de déférasirox se fait tous les 3 mois à 6 mois en fonction des variations de la ferritinémie.
Les ajustements doivent être :
- réalisés par paliers de 5 à 10 mg/kg.
- adaptés à la réponse individuelle du patient et aux objectifs thérapeutiques.
- Des doses allant jusqu’à 40 mg/kg peuvent être envisagées chez les patients qui ne sont pas correctement contrôlés à des doses de 30 mg/kg (par exemple ferritinémie persistant en-dessus de 2500 μg/l et n’ayant pas tendance à diminuer avec le temps).
- À des doses supérieures à 30 mg/kg, d’autres options thérapeutiques sont à envisager si :
- Un très faible contrôle de l’hémosidérose est atteint.
Si un contrôle satisfaisant n’est pas atteint.
- Les données d’efficacité et de sécurité d’emploi à long terme avec des doses de déférasirox supérieures à 30 mg/kg sont actuellement limitées, des doses supérieures à 40 mg/kg sont déconseillées.
- Chez les patients traités à des doses supérieures à30 mg/kg, des réductions de dose par paliers de 5 à 10 mg/kg devront être envisagées quand le contrôle a été atteint (par exemple ferritinémie persistant au-dessous de 2500 μg/l et ayant tendance à diminuer avec le temps).
- Chez les patients pour lesquels la ferritinémie a atteint son objectif (habituellement entre 500 et 1000 μg/l), des réductions de dose par paliers de 5 à 10 mg/kg devront être envisagées afin de maintenir la ferritinémie dans ces valeurs cibles.
- L’interruption du traitement doit être envisagée si la ferritinémie chute de façon persistante en dessous de 500 μg/l.
Dernière Mise à jour : octobre 2017
Le méthotrexate par voie orale est prescrit depuis des années en rhumatologie pour le traitement de certaines formes de polyarthrites rhumatoïdes et de psoriasis (5).
Le méthotrexate est à utiliser avec précaution en raison d’effets indésirables parfois graves doses dépendants (1, 2, 3).
Des patients ont été gravement intoxiqués suite à une surdose ; chez la moitié de ces patients la surdose a été la conséquence d’une erreur de prise de la dose prescrite, une fois par jour au lieu d’une fois par semaine (1, 2, 3).
La connaissance des signes précoces d’une éventuelle intoxication (syndrome pseudo grippal, nausées, vomissements, diarrhée, toux sèche, douleurs dans la poitrine, difficultés respiratoires, plaies de la peau et des muqueuses), par le patient et son entourage est d’importance capitale pour éviter les conséquences graves de surdosage qui sont parfois fatales (1, 2, 3).
Pour éviter un risque de surdosage, des mesures de sécurité sont à mettre en œuvre lors d’un traitement par méthotrexate :
Mesure à l’attention des patients :
- Noter sur la boite le jour de la semaine et le nombre de comprimés à prendre et la date de la première prise.
- Tenir à jour, une fiche de suivi indiquant le nombre de comprimés (initial, pris et restant).
- Recompter le nombre de comprimés restant. En cas de doute, il est préférable de ne pas prendre le méthotrexate.
- Signaler immédiatement au médecin tout signe susceptible d’être dû à un surdosage.
- Informer les soignants lors de la prise du méthotrexate, et présenter les documents (ordonnance et bilans) en cas d’hospitalisation ou de consultation (1, 2, 3).
Mesure à l’attention du prescripteur :
- Bénéficier d’une attention particulière, pour patients âgés et/ou présentant des troubles cognitifs.
- Préciser sur l’ordonnance le jour de la semaine de prise du médicament. Aucune abréviation ne doit être utilisée pour désigner le jour de la semaine prévu pour l’administration (4).
Mesure à l’’attention du laboratoire fabriquant :
- Mettre une information lisible sur l’emballage du médicament dans un encadré rouge figurément sur les boîtes de ce médicament stipulant que le médicament ne doit pas être pris tous les jours (5).
Bibliographie :
- 20-1-4.patient sous méthotrexate ʺRev prescrire2017 ; 37 (401 suppl.interactions médicamenteuses).
- méthotrexate oral à 10mg : attention aux surdoses avec dosage fort,et un conditionnement à risque ʺRev Prescrire 2011 ;31(331) :346-347.
- méthotrexate par voie orale : prévenir les surdoses par erreurʺRev Prescrire 2007 ; 27(283) :352-355..
- http://www.patientensicherheit.ch/fr/publications/Quick-Alerts.html
- www.ansm.santé.fr
Les hydroxyethylamidons (HEA), produits de substitution volémique colloïdal synthétique sont parmi les solutés administrés par voie intraveineuse pouvant être utilisés en réanimation par fluides.
Ils favorisent la rétention d’eau, augmentant ainsi le volume plasmatique, permettant le contrôle des chutes du débit sanguin et la baisse de la tension artérielle.
Les HEA sont utilisés depuis plus de 20 ans dans les hôpitaux de tous les pays. Les molécules d’HEA possèdent des caractéristiques physico-chimiques différentes leur conférant des propriétés pharmacocinétiques particulières.
Plusieurs études menées concernant l’emploi de l’HEA ont montré une augmentation de la mortalité comparée à d’autres produits ainsi qu’une augmentation des risques d’insuffisances rénales expliquant certaines mortalités.
D’autres études n’ont pas montré ce type d’effets indésirables.
Afin de sécuriser l’emploi de l’HEA, des contre-indications d’HEA ont été émises, à savoir :
- Les patients présentant une septicémie ;
- Les patients présentant des troubles hépatiques graves ;
- Les patients présentant une déficience rénale avec oligurie et anurie, non liée à l’hypovolémie.
De ce fait, l’utilisation clinique de l’HEA dans le cas de réanimation volumique aiguë n’est pas justifiée en raison de graves problème de sécurité.
Une prudence particulière lors de l’emploi de ces solutions est de rigueur auprès de patients atteints de troubles rénaux.
En pratique : Les patients nécessitant des soins intensifs ou d’urgence, l’utilisation de cristalloïdes plutôt que des solutions à base d’HEA doit être évaluée.
Dernière Mise à jour : Mai 2018
Information destinée aux professionnels de la santé.
Objet : Amphotéricine B injectable, risques d’erreurs.
Le Centre National de Pharmacovigilance et de Matériovigilance (CNPM) attire l’attention des praticiens sur le risque d’erreurs de prescription, de dispensation, de préparation ou d’administration des trois formes d’amphotéricine B injectable dont les posologies sont différentes.
Il existe une forme dite conventionnelle d’amphotéricine B, le désoxycholate d’amphotéricine B (Fungizone°) ; et deux formes lipidiques : un complexe phospholipidique (Abelcet°) et une forme liposomale (AmBisome°). Ces deux dernières spécialités ne sont pas encore disponibles en Algérie .
Les erreurs concernent principalement l’administration de Fungizone® à la place d’AmBisome®, à la posologie et au débit d’administration de ce dernier , ayant pour conséquence un surdosage en amphotéricine B, pouvant entrainer de graves atteintes cardiaques ou rénales.
Recommandations d’utilisation :
- Non interchangeabilité des médicaments injectables à base d’amphotéricine B : il n’est pas possible de substituer une spécialité à base d’amphotéricine B par une autre.
- Importance de prescrire les médicaments en DCI (dénomination commune internationale) et en nom de marque afin d’éviter tout risque de confusion entre les différentes formulations d’amphotéricine B (à cette date il n’existe pas encore de générique de ces spécialités en Algérie).
- Rappel des modalités spécifiques de préparation et d’administration
- Fungizone® et AmBisome : reconstitution avec de l’eau PPI uniquement.
- Abelcet® suspension : pas de reconstitution.
- Abelcet®, Fungizone® et AmBisome: dilution avec une solution injectable de glucose uniquement.
- Il est important de rappeler que l’amphotericine B n’est pas compatible avec le chlorure de sodium (NaCl) à 0,9% ou les solutions contenant des bactériostatiques.
- Ne pas mélanger avec d’autres traitements ou électrolytes. Ces spécialités ne doivent pas être administrées par une ligne intraveineuse ayant contenu du chlorure de sodium à 0,9% sauf si cette ligne a d’abord été rincée avec une solution injectable de glucose.
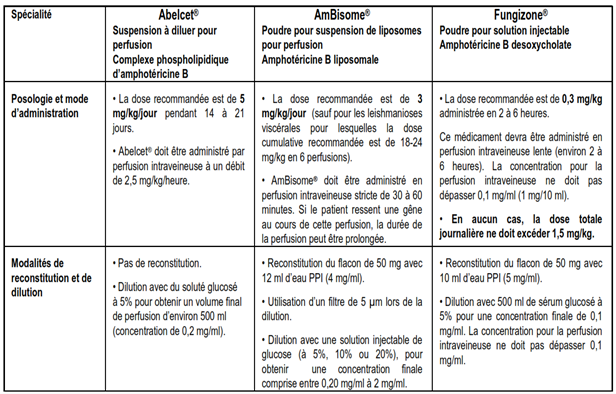
Il est important de lire attentivement et de suivre les instructions présentées sur l’étiquette du flacon et sur l’étui avant de réaliser la reconstitution et la dilution d’une spécialité injectable à base d’amphotéricine B.
En pratique : Prescrire, dispenser (étiqueter la perfusion) et administrer en différenciant les formes : désoxycholate d’amphotéricine B (Fungizone°), complexe phospholipidique d’amphotéricine B (Abelcet°) et liposomes d’amphotéricine B (AmBisome°), dans ces situations à risque élevé d’erreur, l’expression en dénomination commune internationale (DCI) est utile, ne pas préciser la spécialité est dangereux.
Tout effet indésirable suspecté d’être dû à un médicament dont les professionnels de la santé ont connaissance est à déclarer au Centre National de Pharmacovigilance et de Matériovigilance (www.cnpm.org.dz).
Dernière Mise à jour : Mai 2018
RESUME : Tout le monde parle du mauvais usage des médicaments, mais chacun des protagonistes lui donne sa propre explication. La politique en parle pour dire qu’il y a du gaspillage de médicaments et du budget de l’Etat. Le citoyen pour dire que le médecin prescrit plus qu’il n’en faut pour soigner ses malades et les rend par conséquent, responsable d’une partie des pertes financières qui pèsent sur leur budget familial. Le médecin donne une autre explication et pense que l’on veut réduire sa liberté de prescription et de jugement devant son malade. Le pharmacien qui reçoit son client à l’officine n’a pas d’opinion à porter sur un sujet qui regarde plutôt le médecin. Il est donc difficile de mettre d’accord tout ce monde à travers une telle cacophonie, si bien que chacun préfère garder pour lui ses explications sur les causes et les solutions à donner au problème et du coup, rien ne se fait. Néanmoins, les gouvernements au premier degré et les organisations professionnelles et internationales au second degré, doivent remplir leurs obligations envers les populations pour que les médicaments soient administrés en conformité avec les besoins des malades, pour qu’ils soient efficaces, avec une bonne innocuité, un bon coût et prescrit de surcroît en adéquation avec les états physiques des patients puis les dispenser de manière sécurisée. Voila tout un programme qui vaut la peine d’être entrepris, mais il ne trouve pas malheureusement beaucoup de preneurs pour l’instant. MOTS-CLES : Bon usage – Médicaments essentiels – Apprentissages par problèmes – Bien prescrire – Bien dispenser. ———————————————
Télécharger l’intégralité de l’article cliquez sur le lien suivant : Clicquer ici [PDF – 54 KO]
Dernière Mise à jour : Mars 2017
Evaluation du rapport bénéfices/ risques du Valproate et dérivés (Dépakine®) suite à l’accord du groupe de coordination pour les procédures de reconnaissance mutuelle et décentralisées (CMDH) modifiant les conditions de traitement des enfants et adolescents de sexe féminins et des femmes en âge de procréer. La modification introduite par les laboratoires Sanofi-Aventis Algérie concernant la mise à jour de la rubrique « conditions de prescription et de délivrance » du Résumé des Caractéristiques des Produits (RCP).
De nombreuses études de suivi de grossesse de femmes épileptiques ont montré que l’acide valproique (AV) est plus tératogène que d’autres antiépileptiques.
Le risque de malformations est d’autant plus important que la posologie est élevée s’agissant d’un effet indésirable dose dépendant.
Les malformations associées à l’AV sont des anomalies de fermeture du tube neural, des anomalies urogénitales, craniofaciales, et digitales ainsi que des anomalies cardiaques et des membres.
Les résultats de plusieurs études convergent pour montrer qu’une exposition in utéro à l’AV entraine des:
- conséquences sur le développement psychomoteur dans l’enfance: déficit du quotient intellectuel, retard de développement.
- difficultés d’adaptation comportementale des enfants, des symptômes autistiques et des syndromes d’Asperger.
- parfois altération du développement cognitif.
Conclusion :
Conformément aux recommandations du résumé des caractéristiques des spécialités à base d’Acide Valproïque, son utilisation est déconseillée tout au long de la grossesse et chez les femmes en âge de procréer sans contraception efficace, ainsi que chez l’enfant.
Néanmoins, si une grossesse est envisagée, réévaluer d’abord avec la patiente le choix de l’acide Valproïque compte tenu des risques de malformations et de troubles du développement. Si l’AV est néanmoins maintenu, il est souhaitable de privilégier la dose journalière minimale efficace et d’instaurer une supplémentation en acide folique en amont de toute grossesse, et pendant le premier trimestre de grossesse, afin de réduire les risques.
Les anthracyclines, des anticancéreux, isolées à partir de micro-organismes, utilisées principalement dans les leucémies myéloblastiques et dans les leucémies lymphoblastiques aiguës (1). Un certain nombre d’effets indésirables obesrvés, notamment cardiaques, limitent leur utilisation.
Les anthracyclines peuvent produire une toxicité aiguë et transitoire de la fonction cardiaque caractérisée par des anomalies à l’ECG (troubles du rythme cardiaque, allongement de l’espace QT le plus souvent sans traduction clinique), associés parfois à des troubles électrolytiques (hypokaliémie et hyponatrémie) qui doivent être corrigés. Les anomalies sont généralement réversibles (1) (2). Les anthracyclines peuvent aussi induire une toxicité chronique (liée à des doses cumulatives) à type d’insuffisance cardiaque congestive retardée, irréversible, parfois mortelle. Une insuffisance cardiaque tardive peut survenir jusqu’à 18 ans après un traitement par anthracyclines (1).
La cardiotoxicité est un effet indésirable majeur à l’origine d’une limitation de l’utilisation des anthracyclines, comme la doxorubicine et la daunorubicine. Des médicaments dérivés ont été mis au point dans le but de réduire la cardiotoxicité : l’acarubicine, l’épirubicine, idarubicine, la mitoxantrone et la pixantrone. Cependant, bien que cette stratégie ait rencontré un certain succès, tous ces composés présentent un certain degré de cardiotoxicité (1).
Certains facteurs peuvent augmenter le risque de toxicité notamment:
- Doses cumulatives totales ;
- Schéma posologique : des doses uniques élevées peu fréquentes sont plus cardiotoxiques que des doses plus faibles et plus rapprochées, ce qui suggère que la cardiotoxicité est liée aux pics de concentration sanguine ;
- Ages extrêmes (enfants, patients âgés) ;
- Antécédents de radiothérapie thoracique ;
- Antécédents de maladie cardiovasculaire à type d’insuffisance cardiaque classe III ou IV augmente le taux de mortalité ;
- Autres facteurs de risque tels que : hypertension, hépatopathie, hyperthermie, et trisomie 21 (1).
Prévention de la cardiotoxicité des anthracyclines :
Une surveillance clinique et paraclinique est nécessaire avant toute utilisation d’anthracyclines notamment :
- ECG : la plupart des modifications sur l’ECG ne sont pas prédictives de la cardiotoxicité, qui peut survenir sans celles-ci. Cependant une réduction persistante de la tension de l’onde QRS indique généralement la nécessité d’effectuer d’autres tests.
- Echocardiographie ou angiographie isotopique : utile pour prédire le développement d’une cardiomyopathie, mais peut donner des résultats normaux. La sensibilité peut être améliorée avec les tests d’efforts physiques. La mesure de la fraction d’éjection ventriculaire gauche (FEVG) est fréquemment utilisée pour l’évaluation de base, puis à intervalles réguliers par la suite.
- Imagerie à l’antimyosine à l’indium-111 : détecte une absorption cardiaque anormale à cette substance radioactive qui peut être observée même en l’absence de changement de la FEVG et peut être prédictive d’une chute imminente de la FEGV. Cette technique est très sensible.
- Biopsie endomyocardique : indicateur le plus sensible, mais technique invasive et encore peu disponible (1).
Conclusion :
Les anthracyclines peuvent être à l’origine d’une toxicité cardiaque redoutable limitant leur utilisation ; cependant lorsque leur utilisation est nécessaire, une surveillance cardiaque plus étroite est indispensable avant, pendant et après traitement.
Références bibliographiques :
- (1) Martindale, The Complete Drug Reference ; ”Antineoplasics ; daunorubicin, doxorubicin citrate” ; 38th Edition, 777, p. 783 ; disponible sur le site http : //www.medicinescomplete.com/3./content/martindale/21514-e.21035-t.
- (2) Vidal ; ”Daunorubicine ; effets indésirables ; toxicité cardiaque” ; 92ème Edition, p. 477.
Les quinolones et les fluoroquinolones sont des antibiotiques administrés par voie systémique ou par voie inhalée, utilisés pour traiter des infections bactériennes au cours desquelles le pronostic vital peut être engagé.
Bien qu’ils soient rares, des effets indésirables graves, durables, invalidants et potentiellement irréversibles, affectant principalement le système musculo-squelettique et le système nerveux ont été rapportés avec les antibiotiques de la famille des (fluoro) quinolones. En conséquence, la balance bénéfices-risques de tous les antibiotiques de ces deux familles ainsi que leurs indications au sein de l’Union Européenne ont été réévalués.
Les effets indésirables affectant le système musculo-squelettique sont : tendinite, rupture de tendon, douleurs musculaires, faiblesse musculaire, arthralgie, gonflement articulaire et troubles de la marche.
Les effets indésirables affectant le système nerveux périphérique et le système nerveux central sont : neuropathie périphérique, insomnie, dépression, fatigue, troubles de la mémoire ainsi que troubles de la vue, de l’audition, de l’odorat et du goût.
Les médicaments à base de (fluoro) quinolones ne doivent pas être prescrit pour :
- Traiter des infections non sévères ou spontanément résolutives (par exemple : pharyngite, angine et bronchite aiguë) ;
- Prévenir la diarrhée du voyageur ou les infections récidivantes des voies urinaires basses ;
- Traiter des infections non bactériennes. Exemple, la prostatite chronique non bactérienne ;
- Traiter des infections de sévérité légère à modérée (notamment cystite non compliquée, exacerbation aiguë de la bronchite chronique et de la broncho-pneumopathie chronique obstructive [BPCO], rhino-sinusite bactérienne aiguë et otite moyenne aiguë), à moins que les autres antibiotiques habituellement recommandés pour ces infections ne soient jugés inappropriés ;
- Traiter des patients ayant déjà présenté des effets indésirables graves avec un antibiotique de la famille des quinolones ou fluoroquinolones.
En pratique, la prescription des médicaments à base de (fluoro) quinolones ne doit être faite qu’après une évaluation individuelle approfondie de la balance bénéfices-risques pour chaque patient. L’information des prescripteurs et des malades, la surveillance des effets indésirables du traitement est primordiale afin d’éviter les risques liés au traitement.
Bibliographie :
- ʺAntibiotiques de la famille des quinolones et fluoroquinolones administrés par voie systémique ou inhalée : risque d’effets indésirables invalidants, durables et potentiellement irréversibles et restrictions d’utilisation – Lettre aux professionnels de santéʺ. www.ansm.santé.fr. 07 pages. Consulté le 15/04/2019.
- ʺMédicaments contenant de la quinolone et de la fluroquinoloneʺ https://www.ema.europa.eu/en/medicines/human/referrals/quinolone-fluoroquinolone-containing-medicinal-products. 03pages. Consulté le 15/04/2019
- ʺLes fluoroquinolonesʺ.https://www.uptodate.com/contents/search. . 34 pages. Consulté le 23/04/2019
- ʺ Fluoroquinolonesʺ. Guide des interactions médicamenteuses. Rev prescrire 2018. (322): 479-480.
Dernière mise à jour : Mai 2019
Le hoquet est un réflexe moteur associant une brusque contraction des muscles inspiratoires à une fermeture de la glotte à l’origine d’un bruit caractéristique (1,2 3).
En général, le hoquet est bénin lorsqu’il est aigu, mais peut atteindre divers degrés de gravité quand il devient persistant, on parle de hoquet chronique lorsqu’il dure plus de 48 h (2).
Les principales causes de hoquets chroniques sont des troubles œsophagiens, des troubles neurologiques, des maladies inflammatoires, tumorales, infectieuses ou métaboliques qui stimulent les voies nerveuses impliquées dans le hoquet, et le hoquet psychogène (1, 2,3).
Les médicaments sont rarement à l’origine d’un hoquet, le mécanisme de survenue n’est pas élucidé. Lorsqu’il est dû à un médicament, le hoquet survient en général après un certain délai, et ne cesse qu’à l’arrêt du médicament (1).
Divers médicaments sont impliqués à savoir : (3, 4, 5,6, 7, 8,9).
| Classe médicamenteuse | Médicament |
|---|---|
| Des corticoïdes (voie orale ou parentérale) +++ | La dexaméthasone, la bétaméthasone |
| Des benzodiazépines +++ | -Le lorazépam, le lormétazépam, le midazolam en anesthésie. |
| Des antibiotiques ++ | La doxycycline, la ceftriaxone, l’association sulfaméthoxazole + triméthoprime (alias cotrimoxazole) . |
| Des antiémétiques ++ | Les sétrons tels que l’ondansétron, l’aprépitant |
| Un antirétroviral, inhibiteur de la protéase du HIV | Le darunavir. |
| Un hypotenseur | La méthyldopa |
| Des anti-inflammatoires non stéroïdiens (AINS) | L’aprépitant, et son précurseur le fosaprépitant. |
| Un opioïde | Le tramadol. |
| Des antiépileptiques | L’éthosuximide, le phénobarbital. |
| Un médicament d’aide au sevrage tabagique | La nicotine. |
| Un stimulant respiratoire | Le doxapram |
| Un inhibiteur de la topoisomérase II dérivé de la podophyllotoxine | L’étoposide. |
| Un médicament utilisé comme cytoprotecteur | L’amifostine |
| Des antiparkinsoniens agonistes dopaminergiques | La levodopa, la carbidopa. |
| Des antidépresseurs | Non précisé. |
| +++ Très fréquent ++ Fréquent |
|
Remarque : L’association de plusieurs médicaments qui exposent à un hoquet majore ce risque (10).
En pratique, face à un hoquet persistant, évoquer une cause médicamenteuse, et arrêter le médicament suspect soulage parfois le patient, et permet aussi d’éviter des examens à visée diagnostiques inutiles et parfois dangereux (10,11).
Bibliographie :
- “Les hoquets dus aux médicaments” Rev Prescrire 1998. 18 (184): 362-363.
- “Le hoquet chronique” Rev Prescrire 1993. 13 (134): 612-613.
- “Chlorpromazine”. In : “Martindale : 40 pages.
- “Methylprednisolone”. In : “Martindale”: 10 pages.
- “Hoquet induit par les benzodiazépines” Rev Prescrire 2003. 23 (245): 83.
- “Midazolam”. In: “Martindale”: 14 pages. 7”Imipenem” (2006).
- ”Imipenem (2006). In : “Martindale” : 8 pages.
- “Ceftriaxone sodium. In : “Martindale” : 7 pages.
- “Ondansetron”. In : “Martindale” : 12 pages.
- “Hoquets médicamenteux en bref’’ Rev prescrire 2018. 38 (416): 265.
- “Hoquet d’origine médicamenteuse’’ RevPrescrire 2008. 28 (29): 25.
Dernière mise à jour : Septembre 2018